微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到浓硫酸。
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO2,反应的化学方程式为:_____________,该反应在_______中进行(填仪器名称)。
(2)为了有利于SO2转化为SO3,且能充分利用热能,采用了多层催化剂且有热交换器的________(填仪器名称)中进行反应。在如图所示的装置中, C处流出的气体有__________;SO3进入__________(填仪器名称)用_____________吸收,得到浓硫酸或发烟硫酸。
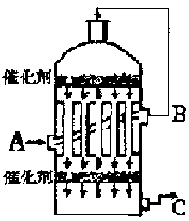
(3)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是______________。

(4)现在欲提高SO2的反应速率和转化率,下列措施可行的是_______。
A.向装置中通入氮气且保持体积不变
B.向装置中通入氧气且保持体积不变
C.添加更多的催化剂
D.降低温度,及时转移SO3
(5)由吸收塔排出的尾气中有SO2的含量如果超过500μL/ L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式__________________。
参考答案:(1) ; 沸腾炉
; 沸腾炉
(2)接触室;SO3、SO2、O2 ;吸收塔;98.3%的H2SO4
(3)400℃,1个标准大气压
(4)B
(5)2NH3·H2O + SO2 =(NH4 )2SO3 + H2O
本题解析:
本题难度:困难
2、填空题 化学原理常应用于工业生产,如氯碱工业和硫酸工业
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式___________________________
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式_______________________,第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式_____________________________。
参考答案:(1)饱和食盐水;H2、NaOH;2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)沸腾炉;2SO2+O2 2SO3;NaOH(aq)+H2SO4(aq)==Na2SO4(aq)+H2O(l) ΔH=-2.5Q kJ·mol-1
2SO3;NaOH(aq)+H2SO4(aq)==Na2SO4(aq)+H2O(l) ΔH=-2.5Q kJ·mol-1
本题解析:
本题难度:一般
3、选择题 实验是化学研究的基础,如图所示的实验操作正确的是
A.干煤SO2
B.实验室制取并收集O2
C.装置气密性的检查
D.吸收NH3
参考答案:C
本题解析:分析:A、二氧化硫是酸性氧化物和碱反应;
B、氧气是比空气重的气体,用向上排气法收集;
C、装置气密性主要是利用装置中压强变化和液面变化分析判断;
D、氨气和硫酸反应生成硫酸铵易发生倒吸;
解答:A、二氧化硫是酸性氧化物和碱反应,通过碱石灰被吸收,不能用来干燥,故A错误;
B、氧气是比空气重的气体,应用向上排气法收集,故B错误;
C、装置中注射器推入压强增大,液体在长颈漏斗中上升,说明气密性完好,故C正确;
D、硫酸吸收氨气反应会引起倒吸,故D错误;
故选C.
点评:本题考查了化学实验方案的正误判断,气体收集,干燥净化,气密性检查方法判断,题目难度中等.
本题难度:困难
4、填空题 合成氨工业对国民经济和社会发展具有重要的意义。合成塔中发生反应为N2 (g) +3H2(g)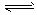 2NH3(g)
2NH3(g)
△H<0。
(1)工业生产时,制取氢气的一个反应为CO(g)+H2O(g)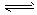 CO2(g) +H2(g) △H>0。
CO2(g) +H2(g) △H>0。
①T℃时,向1 L密闭容器中充入0.2 mol CO和0.3mol水蒸气,达到平衡后,体系中c(H2)=0.12 mol·L-1。该温度下此反应的平衡常数K=____。
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当重新建立平衡时,水蒸气的总转化率α(H2O)= ________。
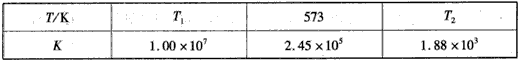
(2)下表为不同温度下合成氨反应的平衡常数。由表可推知T1____573 K(填“>”、“<”或“=”)。
(3)673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如下图所示,下列有关叙述正确的是___(填序号)。

A.c点表示n( NH3)和n(H2)相等
B.c点表示NH3生成的速率与NH3分解的速率相同
C.在e点和d点时,反应的平衡常数相等
D.c点时正反应速率大于逆反应速率
(4)工业上利用NH3制硝酸的过程中有反应:3NO2 +H2O==2HNO3 +NO,从生产流程看,吸收塔中需要补充空气,试分析其原因:___ 。
(5)硝酸厂的尾气中含有氮氧化物,不经处理直接排放会污染空气。目前科学家探索利用气体燃料中的甲烷等将氮氧化物还原为氮气和水,其反应机理为
CH4(g)+4NO2(g)==4NO(g)+CO2(g) +2H2O(g) △H=-574 kJ·mol-1
CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) △H=-1 160 kJ·mol-1 则甲烷直接将NO2还原为N2的热化学方程式为___。
参考答案:(1)①1; ②50%
(2)<
(3) ACD
(4)充入空气,NO转化为NO2,NO2继续与水反应生成HNO3,有利于提高原料利用率
(5) CH4(g)+2NO2(g)==CO2(g)+2H2O(g)+N2(g) △H= -867 kJ·mol-1
本题解析:
本题难度:一般
5、简答题 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
(1)煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥后进入______(填设备名称),其主要目的是______.
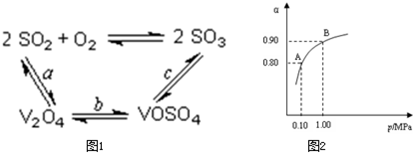
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图1).其中a、c二步的化学方程式可表示为:______、______.
(3)550℃时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如图2所示.则:将2.0mol?SO2和1.0mol?O2置于5L密闭容器中,反应达平衡后,体系总压强为0.10M?Pa.该反应的平衡常数等于______.A与B表示不同压强下的SO2转化率,通常情况下工业生产中采用常压的原因是______.
(4)为循环利用催化剂,科研人员最新研制了一种离子交换法回收钒的新工艺,
回收率达91.7%以上.已知废钒催化剂中含有V2O5、VOSO4及不溶性残渣.查阅资料知:VOSO4可溶于水,V2O5难溶于水,NH4VO3难溶于水.该工艺的流程如图.
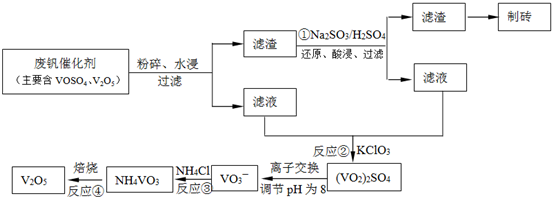
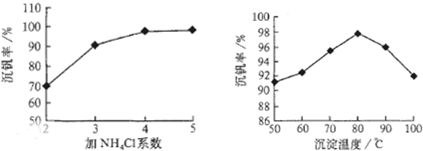
则:反应①②③④中属于氧化还原反应的是______(填数字序号),反应①的离子方程式为______.该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据下图试建议控制氯化铵系数和度:______、______.
参考答案:(1)以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收;其中二氧化硫的催化氧化在催化剂表面和空气中的氧气接触反应,若气体中含有杂质气体容易使催化剂中毒,所以煅烧黄铁矿形成的炉气必须经除尘、洗涤、干燥;故答案为:接触室,防止催化剂中毒.
(2)依据图1中的转化关系,V2O5参与反应先做氧化剂把二氧化硫氧化为三氧化硫,本身被还原为图中产物V2O4;根据氧化还原反应的实质写出并配平a步化学方程式SO2+V2O5?SO3+V2O4;C是VOSO4转化为SO3,此过程需要重新生成催化剂V2O5,需要氧化剂完成,此过程中的氧化剂时氧气,根据化合价的变化写出C步化学方程式?4VOSO4+O2?2V2O5+4SO3;故答案为:4VOSO4+O2?2V2O5+4SO3
(3)2SO2+O2催化剂.△2SO3 体系总压强为0.10M?Pa,此时二氧化硫的转化率为80%
? 2SO2 +O2催化剂.△2SO3
起始量(mol)? 2?1? ?0
变化量(mol)? ? 2×0.8? 0.8? 2×0.8
平衡量(mol)? ? 0.4? 0.2? 1.6
平衡时各物质的浓度为:[SO2]=0.08mol/L,[O2]=0.04mol/L,[SO3]=0.32mol/L,代入平衡常数的计算式得到平衡常数K=[SO2]2??[SO2]2?[O2]=400?L?mol-1,
从图象中可以看出,常压SO2就可以达到较高的转化率,压强的增加引起SO2转化率的变化并不明显,所以工业上直接采用常压;
故答案为:400?L?mol-1,使用常压SO2就可以达到较高的转化率;
(4)依据离子交换法回收钒的新工艺流程图分析反应过程中:
①的目的是把难溶的五氧化二钒还原为溶于水的VOSO4;
②的目的是用KClO3还原为VOSO4为(VO2)2SO4;
③因为NH4VO3难溶于水,此步骤的目的是沉淀VO3-
④是分解NH4VO3得到V2O5;
工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度.根据图示分析数据,80℃时沉矾率最高为98%,所以加NH4Cl的系数从图中读出为4;
故答案为:①②;V2O5+SO32-+4H+=2VO2++SO42-+2H2O;4和80℃;
本题解析:
本题难度:一般