微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
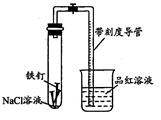
(1)实验前用碱液清洗铁钉,再用0.100mol/L的H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_____ 。
(2)为尽量减小误差,下列操作的正确顺序是______ (填序号)。
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为__ ____ ;用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,②______ 。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH不同
假设二:NaCl溶液的浓度不同
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:

①当pH=2时,没有观察到稳定液柱形成的原因是__ ____
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:___________ ;
第二步::相同温度下,加入系统表面积的铁钉,组装两套完全相同的上述装置,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
参考答案:(1)除去铁钉表面的铁锈;
(2)⑤①④②③
(3)4Fe+3O2+6H2O=4Fe(OH)3;吸入导管内的品红溶液;
(4)铁钉的表面积(温度、催化剂)
(5)①溶液的酸性太强,铁容易发生析氢腐蚀;
②6.0<PH≤6.5
③配置不同浓度的NaCl溶液;
本题解析:(1) 铁钉表面由铁锈,可以用稀硫酸除去。(2) 试验装置装药品之前首先要检验气密性,(3) 氯化钠溶液显中性,铁钉在中性溶液中和氧气发生吸氧腐蚀,总反应为:4Fe+3O2+6H2O=4Fe(OH)3;随着反应的进行,试管内氧气减少,压强降低,在大气压的作用下,烧杯中的品红溶液进入带刻度导管,反应掉的氧气等于导管内的品红溶液的体积(4) 实验时发现上述测量过程因反应较慢耗时较长,说明反应速率慢,回答问题时应该从影响化学反应速率的因素方面答题;(5)①当pH=2时,溶液显酸性,铁钉发生析氢腐蚀,产生气体,液柱为0;②当PH的范围为:6.0<PH≤6.5反应的时间最短,产生的液柱最高。③假设二为NaCl溶液的浓度不同,首先要配置不同浓度的NaCl溶液。
考点: 钢铁腐蚀 影响化学反应速率的因素
本题难度:困难
2、选择题 反应C(s)+H2O(g)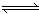 CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一容积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.在密闭容器中通入水蒸气
B.升温
C.保持体积不变,充入氦气使体系压强增大
D.保持压强不变,充入氦气使容器体积增大
参考答案:C
本题解析:考查外界条件对反应速率的影响。增大水蒸气浓度,反应速率增大,升高温度反应速率增大,保持体积不变,充入氦气使体系压强增大,但物质但浓度不变,反应速率不变。保持压强不变,充入氦气使容器体积增大,物质的浓度减小,反应速率降低,答案选C。
本题难度:一般
3、选择题 对于反应A2+3B2=2C来说,以下表示中,反应速率最快的是?(?)
A. v(B2)="0.8" mol/ (L·s)? B. v(A2)="0.4" mol/ (L·s)
C. v(C)="0.6" mol/ (L·s)? D. v(B2)="1.8" mol/ (L·s)
参考答案:D
本题解析:根据反应A2+3B2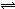 2C,可以选B2为参照,根据化学反应速率之比=方程式的系数之比这一结论,转化为用同种物质表示的反应速率分别为:
2C,可以选B2为参照,根据化学反应速率之比=方程式的系数之比这一结论,转化为用同种物质表示的反应速率分别为:
A、V(B2)=0.8mol/(L?s);
B、v(B2)=1.2mol/(L?s);
C、v(B2)=0.9mol/(L?s)
D、v(B2)=1.8mol/(L?s),所以最大的是D。
故选D。
点评:化学反应中,可以用不同的物质来表示这一反应的反应速率,数值可能不同但表示的意义相同,注意D中的单位。
本题难度:一般
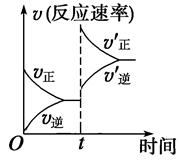
4、选择题 一定条件下,可逆反应C(s)+CO2(g)  ?2CO(g)? ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是?(?)
?2CO(g)? ΔH>0,达到平衡状态,现进行如下操作:①升高反应体系的温度;②增加反应物C的用量;③缩小反应体系的体积;④减小体系中CO的量。上述措施中一定能使反应的正反应速率显著加快的是?(?)
A.①②③④
B.①③
C.①②
D.①③④
参考答案:B
本题解析:①升高体系温度、③增大体系压强均能加速反应速率;②C为固体,不会影响反应速率;④减少CO的量会减小反应速率。
本题难度:一般
5、选择题 一定量的稀H2SO4与过量铁粉反应时,为减缓反应速率,且不影响生成H2的总量,可采取的措施是
A.将铁粉改为铁片
B.向稀H2SO4中加入少量的CuSO4溶液
C.向稀H2SO4中加入少量的CH3COONa固体
D.向稀H2SO4中加入少量的NaOH固体
参考答案:AC
本题解析:略
本题难度:一般