微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
CO2(g)+H2(g),其正反应放热。现有三个相同的2 L恒容绝热(与外界没有热量交换)密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2和1 mol H2,在Ⅲ中充入2 mol CO和2 mol H2O,700 ℃条件下开始反应。达到平衡时,下列说法正确的是( )
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和小于1
参考答案:CD
本题解析:容器Ⅰ中反应正向进行,放出热量,容器Ⅱ中反应逆向进行,吸收热量,两个容器中反应温度不同,则Ⅰ、Ⅱ中正反应速率不相同,A错。容器Ⅲ中加入反应物的量比容器Ⅰ中多,由于该反应为放热反应,Ⅲ中放出热量比Ⅰ多,Ⅲ中反应正向进行的程度比Ⅰ小,因此容器Ⅲ中反应的化学平衡常数比Ⅰ小,B错。?Ⅰ中反应正向进行,放出热量,Ⅱ中反应逆向进行,吸收热量,由于容器均为绝热容器,Ⅰ和Ⅱ中反应进行的程度均较小,则C、D均正确。
本题难度:一般
2、选择题 下图是表示:2X(g) +Y(g) Z(g)+2R(g) △H<0的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
Z(g)+2R(g) △H<0的气体反应速率(υ)与时间(t)的关系,t1时开始改变条件,则所改变的条件符合曲线的是
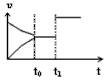
[? ]
A.减少Z物质
B.升高温度
C.加大压强
D.使用催化剂
参考答案:CD
本题解析:
本题难度:一般
3、简答题 分1923年以前,甲醇一般是用木材或其废料的分解蒸馏来生产的。现在工业上合成甲醇几乎全部采用一氧化碳或二氧化碳加压催化加氢的方法,工艺过程包括造气、合成净化、甲醇合成和粗甲醇精馏等工序。
已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:

(1)反应②是____________(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如下图所示。则平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”)。
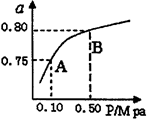
据反应①与②可推导出K1、K2与K3之间的关系,则K3=_________(用K1、K2表示
(3)在3L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如下图所示,若在t0时刻分别改变一个条件,则曲线Ⅰ可变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅱ时,改变的条件是_____________。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是________。
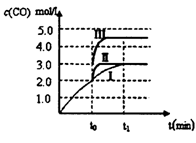
(4)甲醇燃料电池有着广泛的用途,若采用铂为电极材料,两极上分别通入甲醇和氧气,
以氢氧化钾溶液为电解质溶液,则该碱性燃料电池的负极反应式是_________________;
(5)一定条件下甲醇与一氧化碳反应可以合成醋酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为_____________。
参考答案:(1)吸热(2分)?(2) =(2分)? K1·K2?(2分)
(3)加入催化剂(2分); 将容器的体积(快速)压缩至2L(2分,仅答“加压”给1分)
(4) CH3OH-6 e-+8 OH-=CO32-+6 H2O;
(5)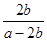 ?×10-7 (3分)
?×10-7 (3分)
本题解析:(1) 反应②随着温度的升高K增大,故正反应为吸热反应;
(2)平衡常数只随温度变化,与压强无关,平衡常数K(A)=K(B);据反应①+②=③可推导反应物质的浓度在K中是幂之积的关系,即K3=K1·K2。
(3)曲线Ⅰ变为曲线II时,反应速率加快,而c(CO)平衡浓度不变,改变的条件是加入催化剂;曲线Ⅰ变为曲线III时,反应速率加快,c(CO)平衡浓度增加,改变的条件是将容器的体积(快速)压缩至2L(仅答“加压”不准确)
(4) 甲醇是该碱性燃料电池的负极,失去电子,反应式是CH3OH-6 e-+8 OH-=CO32-+6 H2O ;
(5)将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-)="2b" mol/L,由电荷守恒得出c(H+)=c(OH-)= 10-7 mol/L;因CH3COOH CH3COO-+H+,醋酸的电离常数为
CH3COO-+H+,醋酸的电离常数为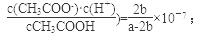
本题难度:简单
4、选择题 决定某化学反应的反应速率的主要因素是( )
A.反应的温度
B.催化剂的使用
C.反应物的浓度
D.反应物的性质
参考答案:因决定化学反应速率的根本原因:反应物本身的性质.而浓度、温度、压强、催化剂是影响因素.故选:D.
本题解析:
本题难度:一般
5、填空题 300℃时,将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g)?△H,2min末达到平衡,生成0.8mol D。
2C(g)+2D(g)?△H,2min末达到平衡,生成0.8mol D。
(1)在2min末时,A的平衡浓度为_____________,B的转化率___________,0-2min内D的平均反应速率为_____________。
(2)该反应的平衡常数表达式为:K=_____________。该温度下的化学平衡常数数值为 =____________。
=____________。
已知350℃时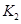 =l,则△H________0(填“>”或“<”)。
=l,则△H________0(填“>”或“<”)。
(3)在300℃时,将该反应容器压缩体积为lL。则A的转化率___________(填“增大”、“减小”或“不变”),原因是__________________。该条件下的平衡常数为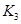 。 则K3________
。 则K3________ ,(填“<”或“>”或“=”)。原因是_______________________。
,(填“<”或“>”或“=”)。原因是_______________________。
(4)能判断该反应是否达到化学平衡状态的依据是__________________(多选扣分)。
A.容器中压强不变 ?B.混合气体中c(A)不变
C. (A)=
(A)=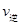 (C)? D.混合气体密度不变
(C)? D.混合气体密度不变
参考答案:(1)0.4mol∕L? 20℅? 0.2 mol∕(L·min)? (2)K={C2(C)C2(D) }∕{C3(A)C (B)}? 0.5? >
(3)不变。增大压强。平衡不移动= K值只与温度有关 。?(4)B
本题解析:(1)根据反应方程式:3A(g)+B(g) 2C(g)+2D(g)可看出:反应时A 、B、C、D的物质的量的关系是3:1:2:2,因为生成0.8mol的D,所以消耗A1.2mol,消耗B0.4mol,生成C0.8mol。故A的平衡浓度为:(2-1.2)mol÷2L="0.4mol∕L" . B的转化率为:0.4mol÷2mol× 100%="20%," 0-2min内D的平均反应速率为V="ΔC∕" Δt="(0.8mol÷2L)" ∕2min=" 0.2" mol∕(L·min).(2)化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的积与各反应物浓度幂指数的积之K={C2(C)C2(D) }∕{C3(A)C (B)}。达到化学平衡时各物质的浓度分别是C(A)=" 0.4mol∕L" ;C(B)="(2-0.4)mol÷2L=0.8mol∕L" ;C(C)=" 0.8mol" ÷2L="0.4" mol∕L ;C(D)=" 0.8mol" ÷2L="0.4" mol∕L。所以化学平衡常数为:K1={(0.4)2×(0.4)2}∕{(0.4)3×0.8}=0.5.又因为在350℃时K2=l,可见升高温度,K增大,说明升高温度化学平衡向正反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。即正反应是吸热反应。故△H>0.(3)将反应容器体积压缩,也就是增大压强。根据化学平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。而该反应是个反应前后气体体积相等的反应,所以增大压强。化学平衡不移动。这时A、B的转化刻率都不会发生变化。化学平衡常数只与温度有关。而与物质投料的多少及次数无关。所以K1=K3. (4)当反应达到化学平衡时各物质的浓度不变,用同一物质表示的正反应速率和逆反应速率相等,个物质的含量不变。由于容器的体积不变,该反应是个反应前后气体体积相等的反应,所以任何时刻压强不变,气体的密度也不变,故它们不能作为判断平衡的标志。正确选项为:B。
2C(g)+2D(g)可看出:反应时A 、B、C、D的物质的量的关系是3:1:2:2,因为生成0.8mol的D,所以消耗A1.2mol,消耗B0.4mol,生成C0.8mol。故A的平衡浓度为:(2-1.2)mol÷2L="0.4mol∕L" . B的转化率为:0.4mol÷2mol× 100%="20%," 0-2min内D的平均反应速率为V="ΔC∕" Δt="(0.8mol÷2L)" ∕2min=" 0.2" mol∕(L·min).(2)化学平衡常数是可逆反应达到化学平衡时各生成物浓度幂指数的积与各反应物浓度幂指数的积之K={C2(C)C2(D) }∕{C3(A)C (B)}。达到化学平衡时各物质的浓度分别是C(A)=" 0.4mol∕L" ;C(B)="(2-0.4)mol÷2L=0.8mol∕L" ;C(C)=" 0.8mol" ÷2L="0.4" mol∕L ;C(D)=" 0.8mol" ÷2L="0.4" mol∕L。所以化学平衡常数为:K1={(0.4)2×(0.4)2}∕{(0.4)3×0.8}=0.5.又因为在350℃时K2=l,可见升高温度,K增大,说明升高温度化学平衡向正反应方向移动。根据化学平衡移动原理:升高温度,化学平衡向吸热反应方向移动。即正反应是吸热反应。故△H>0.(3)将反应容器体积压缩,也就是增大压强。根据化学平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动。而该反应是个反应前后气体体积相等的反应,所以增大压强。化学平衡不移动。这时A、B的转化刻率都不会发生变化。化学平衡常数只与温度有关。而与物质投料的多少及次数无关。所以K1=K3. (4)当反应达到化学平衡时各物质的浓度不变,用同一物质表示的正反应速率和逆反应速率相等,个物质的含量不变。由于容器的体积不变,该反应是个反应前后气体体积相等的反应,所以任何时刻压强不变,气体的密度也不变,故它们不能作为判断平衡的标志。正确选项为:B。
本题难度:一般