微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列各组物质相互反应能得到Al(OH)3的是
A.铝与NaOH溶液反应
B.AlCl3与过量的氨水反应
C.AlCl3与过量的NaOH溶液反应
D.Al2O3与过量的NaOH溶液反应
参考答案:B
本题解析:A选项,产物为偏铝酸钠。B选项,正确。C选项,产物为偏铝酸钠。D选项,产物为偏铝酸钠。
本题难度:一般
2、选择题 14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为 (? )
A.9.6g
B.6.4g
C.3.2g
D.1.6g
参考答案:C
本题解析:n(O2) =" 1.12/22.4" =" 0.05mol" , 0.05mol O2反应得到0.05ⅹ4 = 0.2mol电子
得NO,NO2和O2反应共失去0.2mol电子,即Cu,Ag和HNO3反应共失去0.2mol电子(得失电子守恒),所以有:2ⅹn(Cu) + n(Ag) = 0.2mol,由质量守恒得,有:64ⅹn(Cu) + 108ⅹn(Ag) =" 14g" ,解得n(Cu) = 0.05mol,即m(Cu) = 64ⅹ0.05 =" 3.2g" 。选C
点评:本题如果利用化学方程式来求解,计算过程将会很复杂,如果利用质量守恒与得失电子守恒,将会很好的简化计算。
本题难度:简单
3、填空题 胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解。
②能溶于水,水溶液呈弱碱性。
③遇酸及酸性药物则产生二氧化碳。
④胃酸过多患者服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是____ (填化学式);乙中含有的主要化学成分是____ (填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____ 。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____。
参考答案:(1)NaHCO3 ;Al(OH)3
(2)HCO3-+H+=H2O+ CO2↑
(3)Al(OH)3+OH-=AlO2-+2H2O
本题解析:
本题难度:一般
4、选择题 在H2SO4酸化过的Al2(SO4)3溶液中滴加NaOH溶液,生成沉淀W(g)与所加NaOH溶液体积V的关系如图,其中正确的是
[? ]
A
B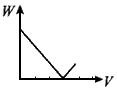
C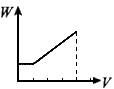
D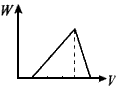
参考答案:D
本题解析:
本题难度:一般
5、选择题 50 g镁、锌、铝的混合物与适量的稀硫酸反应,得三种盐的混合溶液,然后加热、蒸发、结晶得晶体(不含结晶水)218 g,则反应中得H2的质量为(? )
A.2 g
B.3 g
C.3.5 g
D.4.5 g
参考答案:C
本题解析:无论是什么金属与稀硫酸反应,由硫酸的化学式可知,生成物中的n(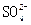 )=n(H2),所以金属与酸反应所得的无水晶体的质量就是金属与硫酸根离子的质量,
)=n(H2),所以金属与酸反应所得的无水晶体的质量就是金属与硫酸根离子的质量,
m(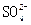 )="218" g-50 g="168" g,则氢气的质量为:
)="218" g-50 g="168" g,则氢气的质量为:
m(H2)=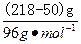 ×2 g·mol-1="3.5" g。
×2 g·mol-1="3.5" g。
本题难度:简单