微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)化学在生活中有很多的应用,如臭氧可用于空气净化、饮用水消毒、工业废物处理和作为漂白剂等,氮化硅(Si3N4)是一种新型陶瓷材料,具有较高的硬度且耐高温。
(1)臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。已知: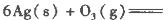
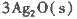 反应生成3 mol Ag2O(s)时放出的热量为
反应生成3 mol Ag2O(s)时放出的热量为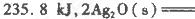
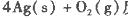 反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
反应生成4 mol Ag(s)时吸收的热量为62.2 kJ,试根据题给数据判断O3转化为O2是________(填“放热”或“吸热”)反应。
(2)氮化硅()可由石英与焦炭在高温的氯气流中通过如下反应制得:
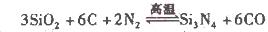
在VL的密闭容器中进行反应,实验数据如下表:
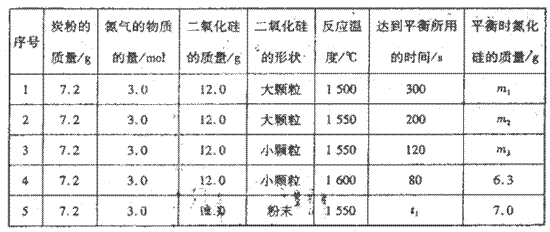
①实验l和实验2表明,________对反应速率有影响,对同一规律研究的实验还有一组是________(填实验序号)。本实验还研究了_______对反应速率的影响。。
②实验5中,t1________(填“>”、“<”或“=”)120,平衡时,二氧化硅的转化率为____________________。
参考答案:(1)放热
(2)①温度;实验3和实验4;反应物的形状;
②<;41.7%
本题解析:(1)根据题目所给信息,结合盖斯定律判断臭氧转化为氧气2O3(g)=3O2(g)的△H=-235.8 kJ/mol×2+62.2 kJ/mol×3=-285kJ/mol<0,所以该反应是放热反应;
(2)① 实验l和实验2的不同之处在于温度的不同,所以实验l和实验2表明温度对反应速率有影响;对同一规律研究的实验还有一组是实验3和实验4,只是温度不同,其他均相同;通过分析表中数据,其他条件相同而二氧化硅的形状不同,反应速率也不同,所以本实验还研究了反应物的形状对反应速率的影响;
②实验5与实验3相比,只是二氧化硅的形状不同,其余条件均相同,反应物的表面积越大,反应速率越快,粉末状比小颗粒的表面积大,所以t1<120;二氧化硅的初始量是12.0g,平衡时的质量是7.0g,所以消耗5.0g,二氧化硅的转化率是5.0g/12.0g×100%=41.7%。
本题难度:一般
2、选择题 化学反应的发生必然伴随有能量的转化,其根本原因是( )
A.化学反应中一定有新物质生成
B.化学反应中旧化学键的断裂需要吸收能量,新化学键的生成需要放出能量
C.化学反应通常需要加热等条件才能发生
D.生成物的总能量与反应物的总能量不同
参考答案:化学反应的发生是旧键断裂和新键生成的过程,其中旧键断裂吸收的能量和新键生成释放的能量不同,化学反应必然伴随能量的变化.
A、化学反应的特征是有新物质生成,新物质的生成不是能量变化的原因,故A错误;
B、化学反应的实质:旧键的断裂和新键的生成,旧化学键的断裂需要吸收能量,新化学键的生成需要放出能量,吸收的能量和释放的能量不同,导致化学反应必然伴随能量的变化,故B正确;
C、加热不是所有化学反应的条件,不是化学反应的发生必然伴随有能量的转化的原因,故C错误;
D、生成物的总能量与反应物的总能量不同,会使得化学反应表现为吸热和放热,不是化学反应的发生必然伴随有能量的转化的原因,故D错误.
故选B.
本题解析:
本题难度:简单
3、选择题 下列变化过程是吸热的有(?)
A.生石灰溶于水变成熟石灰
B.干冰用于舞台布景产生雾
C.稀硫酸与氢氧化钠溶液发生中和
D.浓硫酸稀释成稀硫酸
参考答案:B
本题解析:干冰在常温常压下易升华,并吸收大量热量,使空气中的水蒸气凝聚而产生雾。
本题难度:一般
4、填空题 2SO2(g)+ O2(g)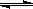 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99kJ。请回答:
⑴Ea的大小对该反应的△H _______(填“有”或“无”)影响。
⑵已知单质硫的燃烧热为296kJ·mol-1,写出反应的热化学方程式:___________?________,常温常压下,由单质硫和氧气经两步反应,生成3mol SO3(g),放出的总热量为 。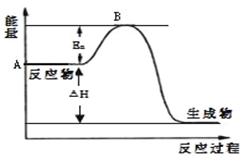
参考答案:⑴无? ⑵S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1? 1185kJ
本题解析:(1)Ea表示反应的活化能,活化能的大小与反应热大小无关系。
(2)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以该反应的热化学方程式是S(s)+ O2(g)="=" SO2(g)△H =-296kJ·mol-1。
(3)根据盖斯定律可知,S(s)+3/2 O2(g)="=" SO3(g)△H =-395kJ·mol-1。 所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
所以生成3mol SO3(g),放出的总热量为395kJ·mol-1×3mol=1185kJ。
本题难度:一般
5、选择题 已知热化学方程式:
① C2H2(g) +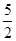 O2(g) ="=" 2CO2(g)+H2O(l)? ΔH1=-1301.0 kJ?mol-1
O2(g) ="=" 2CO2(g)+H2O(l)? ΔH1=-1301.0 kJ?mol-1
② C(s)+ O2(g) ="=" CO2(g)?△H2=-393.5 kJ?mol-1
③ H2(g)+ O2(g) ="=" H2O(1)?△H3 =" -285.8" kJ·mol-1
则反应④ 2C(s)+ H2(g) ="=" C2H2(g)的△H为
A.+228.2 kJ·mol-1
B.-228.2 kJ·mol-1
C.+1301.0 kJ·mol-1
D.+621.7 kJ·mol-1
参考答案:A
本题解析:考查盖斯定律的应用。根据已知反应可知,②×2+③-①即得到④,所以反应热是-393.5 kJ?mol-1×2-285.8 kJ·mol-1+1301.0 kJ?mol-1=+228.2 kJ·mol-1,答案选A。
本题难度:简单