微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现代工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH。请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的电极反应式为____________。
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有:a.Na2CO3溶液,b.Ba(OH)2溶液,c.稀盐酸,其合理的加入顺序为____________(填试剂序号)。
(3)如果在容积为10 L的离子交换膜电解槽中,1 min后阴极可产生11.2 L(标准状况下)Cl2,这时溶液的
pH是(设溶液体积保持不变)____________。
参考答案:(1)2Cl--2e-==Cl2↑
(2)bac
(3)13
本题解析:
本题难度:一般
2、实验题 请从下图中选出必要的装置进行电解饱和食盐水的实验,要求测定产生的H2的体积(大于25 mL),并检验Cl2的氧化性。

(1)A极发生的电极反应式是______________,B极发生的电极反应式是_____________。
(2)电源、电流表与A、B两极的正确连接顺序为L→ ( ?)→?( ?)→ (? )→ ( ?)→ M。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:______接______、______接A、B接______、______接______。
(4)证明Cl2具有氧化性的实验现象是___________________,其中发生反应的离子方程式是______________________________。
(5)已知饱和食盐水150 mL,电流强度为I A,通电为t min时,测得H2体积为16.8 mL(标准状况),此时溶液的pH约为________,阿伏加德罗常数NA的表达式为________________ (电子电量为1.6×10-19 C )。
参考答案:(1)阴极:2H++2e-=H2↑ 阳极:2Cl--2e-=Cl2↑
(2)J K A B
(3)H F G D E C
(4)KI淀粉溶液变蓝,Cl2+2I-= I2+2Cl-
(5)12; 25It×1019
本题解析:
本题难度:一般
3、选择题 化学在生产和日常生活中有着重要的作用。下列说法不正确的是
[? ]
A.电解MgCl2饱和溶液,可制得金属镁
B.在海轮外壳上镶入锌块,可减缓船体的腐蚀速率
C.MgO的熔点很高,可用于制作耐高温材料
D.明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化
参考答案:A
本题解析:
本题难度:简单
4、填空题 如图所示3套实验装置,分别回答下列问题。
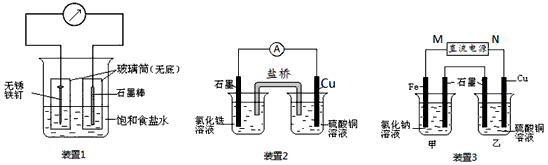
(1)装置1为铁的吸氧腐蚀实验。一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6] 溶液,即可观察到铁钉附近的溶液变蓝色沉淀,表明铁被______(填“ 氧化”或“还原”);向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为__________________。
(2)装置2中的石墨是______极(填“正”或“负”),该装置发生的总反应的离子方程式为________________________。
(3)装置3中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红。
① 电源的M端为______极;甲烧杯中铁电极的电极反应为____________。
② 乙烧杯中电解反应的离子方程式为____________。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64 g,甲烧杯中产生的气体标准状况下体积为________mL。
参考答案:(1)氧化;O2+ 4e- + 2H2O === 4OH-
(2)正;2Fe3+ + Cu === 2Fe2+ + Cu2+
(3)① 正;Fe - 2e-=== Fe2+ ;② 2Cu2++ 2H2O==2Cu + O2↑ + 4H+ ;③ 224
本题解析:
本题难度:一般
5、选择题 下列描述中,不符合生产实际的是
[? ]
A.电解熔融的氯化钠制取金属钠,用铁作阳极
B.电解法精炼粗铜,用纯铜作阴极
C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D.在镀件上电镀锌,用锌作阳极
参考答案:A
本题解析:
本题难度:一般