微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)X、Y、Z为三个不同短周期非金属元素的单质。在一定条件下有如下反应:
Y+X→A(g),Y+Z→B(g)请针对以下两种不同情况回答:
(1)若常温下X、Y、Z均为气体,且A和B化合生成固体C时有白烟产生,则:
①Y的化学式是?。
(2)若常温下Y为淡黄色固体,X、Z为气体,B可把A氧化为Y,则:
①B的化学式是?;
②向苛性钠溶液中通入过量的A,所发生反应的离子方程式是
?
③将Y与(1)中某单质的水溶液充分反应可生成两种强酸,该反应的化学方程式是
?
参考答案:

本题解析:略
本题难度:一般
2、选择题 (14分)中学化学常见的物质A、B、C、D之间存在如下转化关系:
A + B → C + D + H2O。请按要求填空:
(1)若A为短周期元素组成的黑色固体单质,与B的浓溶液共热时,产生C、D两种气体,
C、D两种气体均能使澄清石灰水变浑浊,则A与B反应的方程式是?,已知具有刺激性气味的C气体和Cl2都能漂白某些有色物质,如果将两种气体等物质的量通入到品红溶液中的实验现象为?原因是?。
如果将两种气体非等量通入到水中,为了验证哪种气体过量,某兴趣小组的同学准备了以下试剂: ① 氯化铁溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液? ④ 苯酚溶液
⑤ 品红溶液? ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量溶液滴加至盛有?(选填一个序号)试剂的试管内,再加入
?(选填一个序号)试剂,发生的现象是:?;
若C过量:取适量溶液滴加至盛有?(选填一个序号)试剂的试管内,发生的现象
是:?。
(2)若A在水中的溶解度随温度的升高而降低;B为短周期非金属单质;C是漂白粉的有效成分,则C发生水解反应的离子方程式是?。
(3)若A为五核10电子的阳离子与单核18电子的阴离子构成的无色晶体,受热易分解,分解后生成两种极易溶于水的气体。检验A中阳离子的方法是?
?(简述操作过程及结论)。
参考答案:(1)C + 2H2SO4(浓)  ?CO2↑+2SO2↑+2H2O?(2分)
?CO2↑+2SO2↑+2H2O?(2分)
无现象(1分);Cl2+SO2+2H2O=4H++2Cl―+SO42―,失去漂白性(2分)
②(1分)?③(或④)(1分)?溶液呈现红色(或紫色)(1分)
⑤(或⑥)(1分)?红色褪去(紫红色褪去)(1分)
(2)ClO-+ H2O  ?HClO + OH-?(2分)
?HClO + OH-?(2分)
(3)取少量A溶于水配成溶液于试管中,向该溶液中加入NaOH并加热,用湿润的红色石蕊试纸放于管口检验生成气体,石蕊试纸变蓝证明溶液中含有NH4+。?(或用浓盐酸检验,有白烟生成)?(2分)
本题解析:略
本题难度:简单
3、推断题 有关物质存在如图所示的转化关系(部分产物已省略)。通常C为气体单质,G为紫黑色固体单质。实验室中,常用固体E在B的催化下加热制取气体单质H
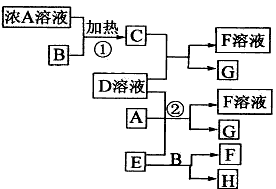
请回答下列问题:
(1)反应①的化学方程式为____________________。
(2)反应②的离子方程式为____________________。
(3)写出另外一种实验室制取H的化学方程式____________________ 。
(4)D溶液与Pb(NO3)2溶液混合可形成沉淀,此沉淀的Ksp=7.0×10-9。将等体积的D溶液与Pb(NO3)2溶液混合,若D的浓度为1×10-2mo1/L ,则生成沉淀所需Pb(NO3)2溶液的最小浓度为____________________。
参考答案:(1)MnO2+HCl=MnCl2+Cl2+H2O
(2)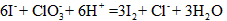
(3) (答案合理即可) (4) 5.6×10-4mol·L-1
(答案合理即可) (4) 5.6×10-4mol·L-1
本题解析:
本题难度:一般
4、填空题 (8分)在一定条件下,某些化学反应可以下图框架表示,根据要求回答下列问题:
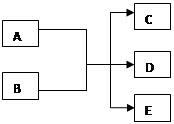
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式?;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为?
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式?
(4)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物的稀溶液,
写出符合上述框图关系的离子方程式 ? 。
参考答案:(1) Cl2+2OH-= Cl-+ClO-+H2O;
(2)2Cl-+2H2O Cl2?+H2?+2OH-;
Cl2?+H2?+2OH-;
(3)C+2H2SO4(浓) CO2?+2SO2?+2H2O;
CO2?+2SO2?+2H2O;
(4)3Cu+8H++2NO3-?=3Cu2++2NO?+4H2O;
本题解析:(1)D具有漂白性,且A、C、D均含氯元素,可联想Cl2+2NaOH=NaCl+NaClO+H2O;
(2)电解饱和食盐水生成氢氧化钠、氢气和氯气。
(3)C、D均能使澄清石灰水变浑浊,C、D应为二氧化碳和二氧化硫,反应方程式为C+2H2SO4(浓) CO2?+2SO2?+2H2O;
CO2?+2SO2?+2H2O;
(4)红色单质为铜,第二周期元素最高价氧化物对应水化物稀溶液可能为H3BO3、H2CO3、HNO3,铜能与稀硝酸反应,离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
点评:本题知识跨度较大,思考容量大。
本题难度:一般
5、推断题 物质A-L之间的转化关系如图,部分反应物和生成物及反应条件已省略。化合物A是由三种元素组成的一种矿石的主要成分。A在氧气中高温煅烧生成B、C、D。B为砖红色固体,D、I均为红色固体,E、I、K是三种常见金属,其中组成E的元素是地壳中含量最高的金属元素。L可作净水剂,向L溶液中加入BaCl2溶液,会生成不溶于稀硝酸的白色沉淀,H溶液呈蓝色。
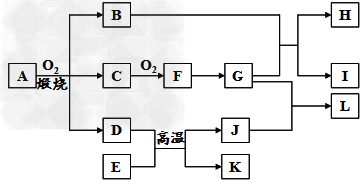
请回答下列问题:
(1)写出E和G的化学式:E__________?、G_________。
(2)L可用作净水剂的原因是__________?(用离子方程式表示)。
(3)写出B和G反应的化学方程式____________________。
(4)D+E→K+J的反应中放出大量的热,这类反应被称为__________反应,举出这类反应的一个应用实例:__________。
(5)A的相对分子质量为184,A与O2反应得到B、C、D三种物质的物质的量之比为1︰4︰1,某种检验葡萄糖的反应中含有B生成,则A的化学式为__________。
(6)过量的I与含n?molG的浓G溶液共热生成m?molC,若给反应后的溶液中加入足量的K的粉末,则溶解掉K的质量为__________g(用含n和m的代数式表示)。?
参考答案:(1)Al;H2SO4?
(2)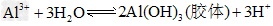 ?
?
(3)Cu2O+H2SO4=CuSO4+Cu+H2O?
(4)铝热;焊接钢轨或冶炼金属
(5)CuFeS2?
(6)56(n-m)
本题解析:
本题难度:一般