微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 从海水中可以获取淡水、食盐,并可提取镁和溴等物质。
(1)中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的是____________。(填序号)?
A、蒸馏?B、蒸发?C、过滤?D、萃取?
(2)从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式为:_______________________
(3)从海水中提取镁的流程如下图所示:?
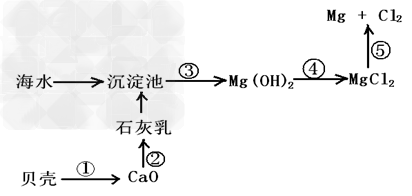
Ⅰ.写出反应④的离子方程式为:_____________ 反应⑤的反应方程式为:_______________
Ⅱ.某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为____________(填“可以”或“不可以”)得到Mg(OH)2?;在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他__________(填“能”或“不能”?)?将Mg2+转化为Mg(OH)2沉淀,理由是________________。(用离子方程式表示)
2、简答题 (附加题)海水中化学资源的综合开发利用,已受到各国的高度重视.Br2和Mg等两种单质都可以从海水中提取,下图为提取它们的主要步骤:
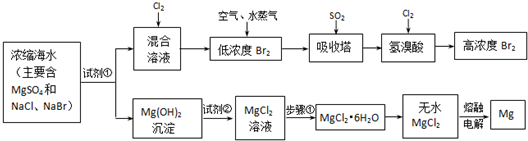
请回答:
Ⅰ.从海水中提取的溴占世界溴年产量的1/3,主要方法就是上述流程中的空气吹出法.
(1)制取Br2时第一次通入Cl2时发生反应的离子方程式是______.
(2)吸收塔中反应的离子方程式是______.
由(1)、(2)可知,SO2、Cl2、Br2三种物质氧化性由强到弱的顺序是______.(用“>”表示)
Ⅱ.镁及其合金是用途很广的金属材料,而目前世界上60%的镁就是从海水中按上述流程提取的.
(1)上述流程中为了使MgSO4完全转化为Mg(OH)2,试剂①可以选用______(写化学式).
(2)加入试剂②后反应的离子方程式是______.
(3)步骤①包括加热、蒸发、冷却、结晶、______.
(4)通电时无水MgCl2在熔融状态下反应的化学方程式是______.
Ⅲ.上述流程在生产溴和镁的同时还可以制得其他化工物质,比如制备耐火材料氧化镁和盐酸.生产方法是:
①将氯化镁晶体(MgCl2?6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体.
②将两种气体冷却至室温,再根据需要,加入不同量的水,就可得到不同浓度的盐酸.
(1)MgCl2?6H2O在523℃以上分解的化学方程式是______.
(2)现用1molMgCl2?6H2O分解所得的非固体产物来制取密度为1.19g/cm3的盐酸溶液168mL,需加水______g(精确到0.1),该盐酸中溶质的物质的量浓度是______mol/L(精确到0.1).
3、填空题 空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下
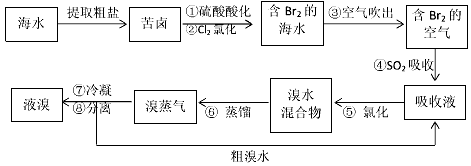
(1)溴在周期表中位于_______周期,_______族。
(2)步骤④的离子方程式:______________。
(3)已知溴的沸点是58.5℃,步骤⑥的蒸馏过程中,溴出口温度为何要控制在80-90℃。温度过高或过低都不利于生产,请解释原因______________。
(4)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。若在实验室分离上述混合物的分离仪器的名称是_______,分离时液溴从分离器的_______(填“上口”或“下口”)排出。
(5)为什么不直接用含溴的海水进行蒸馏得到液溴,而要经过“空气吹出、SO2吸收、氯化”:____________________________。
4、选择题 NaCl是从海水中提取出来的一种重要物质,除了作调味品以外,它还是一种重要的化工原料。下列产品或物质能以NaCl为主要原料制取的是
[? ]
①金属钠; ②氯气; ③烧碱; ④盐酸; ⑤纯碱
A.只有①②
B.只有①②③
C.只有①②③④
D.全部
5、填空题 海水中蕴藏着丰富的资源.海水综合利用的流程图如下:
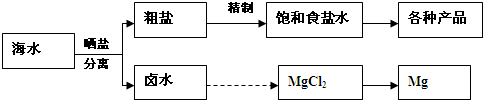
粗盐各种产品卤水MgCl2Mg晒盐分离海水精制饱和食盐水
(1)用NaCl做原料可以得到多种产品.
①工业上由NaCl制备金属钠的化学方程式是______.
②实验室用惰性电极电解100mL?NaCl溶液,若阴阳两极均得到112mL气体(标准状况),则所得溶液的pH为______(忽略反应前后溶液的体积变化).
③电解氯化钠稀溶液可制备“84”消毒液,通电时氯气被溶液完全吸收,若所得消毒液仅含一种溶质,写出相应的化学方程式______.
(2)分离出粗盐后的卤水中蕴含着丰富的镁资源,经转化后可获得MgCl2粗产品.从卤水中提取镁的步骤为:
a.将海边大量存在的贝壳煅烧成石灰,并将石灰制成石灰乳;
b.将石灰乳加入到海水沉淀池中经过滤得到Mg(OH)2沉淀;
c.在Mg(OH)2沉淀中加入盐酸得到MgCl2溶液,再经蒸发结晶得到MgCl2?6H2O;
d.将MgCl2?6H2O在一定条件下加热得到无水MgCl2;
e.电解熔融的氯化镁可得到Mg.
①步骤d中的“一定条件”指的是______,目的是______.
②上述提取镁的流程中,为了降低成本,减少污染,可以采取很多措施,请写出其中一点______.
③有同学认为:步骤b后可加热Mg(OH)2得到MgO,再电解熔融的MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则.你同意该同学的想法吗?______,请说出你同意或不同意的理由______.