微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据图中包含的信息分析,下列叙述正确的是
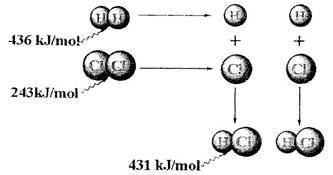
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436 kJ/mol是指断开1 mol H2中的H-H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431kJ/mol是指生成2 mol HCl中的H-Cl键需要放出431 kJ的能量
参考答案:C
本题解析:反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据图中信息可知,该反应的反应热是436 kJ/mol+243 kJ/mol-2×431 kJ/mol=-183 kJ/mol,所以正确的答案选C。
本题难度:简单
2、简答题 (10分)拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ:则(1)1mol N2完全反应生成NH3?热量(填:吸收或放出)??kJ;(2)理论上,每生成1mol NH3,?热量(填:吸收或放出)??kJ;(3)事实上,反应的热量总小于理论值,为什么??。
参考答案:(1)放出;92(2)放出;46?(3)该反应是可逆反应,不能进行完全,有一定限度。
本题解析:(1)N2完全反应生成NH3的方程式为:N2(g)+3H2(g) 2NH3(g)断裂化学键吸收能量,形成化学键释放能量。反应热是二者的相对大小的差值。所以1mol N2完全反应生成NH3时的能量变化是946kJ+3×436kJ-6×391kJ=-92KJ。说明放出92KJ热量。(2)发生反应的物质越多,放出的热量就越多。通过计算可知每产生2mol的NH3放出92KJ热量。则理论上,每生成1mol NH3,放出热量46kJ;(3)但是事实上,由于该反应为可逆反应,反应物不可能完全转化为生成物,所以反应的热量总小于理论值。
2NH3(g)断裂化学键吸收能量,形成化学键释放能量。反应热是二者的相对大小的差值。所以1mol N2完全反应生成NH3时的能量变化是946kJ+3×436kJ-6×391kJ=-92KJ。说明放出92KJ热量。(2)发生反应的物质越多,放出的热量就越多。通过计算可知每产生2mol的NH3放出92KJ热量。则理论上,每生成1mol NH3,放出热量46kJ;(3)但是事实上,由于该反应为可逆反应,反应物不可能完全转化为生成物,所以反应的热量总小于理论值。
本题难度:一般
3、选择题 下列反应中,生成物的总能量大于反应物的总能量的是?
A.氢气在空气中燃烧
B.氢氧化钡晶体与氯化铵晶体反应
C.盐酸与氨氧化钠溶液反应
D.锌与稀硫酸反应制取氢气
参考答案:B
本题解析:生成物的总能量大于反应物的总能量应为吸热反应。A、放热反应,错误;B、正确;C、中和反应为放热反应,错误;D、放热反应,错误。
本题难度:一般
4、选择题 煤经过加工处理后可以得到CO、H2、SO2、CH3OH(甲醇),下列说法错误的是…(? )
A.甲醇和乙醇一样对人体无害
B.CO、SO2都是大气污染物,是导致酸雨形成的主要原因
C.CO、H2都具有可燃性、还原性
D.甲醇可以燃烧,是液体燃料
参考答案:AB
本题解析:甲醇是液体燃料,燃烧后的生成物是CO2和H2O,像水煤气(CO、H2)一样是一种清洁燃料,但甲醇有毒,对人体有害。CO、SO2都是大气污染物,但CO不是导致酸雨形成的原因。
本题难度:简单
5、选择题 下列叙述正确的是
[? ]
A.物质燃烧不一定是放热反应
B.放热反应不需要从外界吸收任何能量就能发生
C.化学反应的实质是旧键的断裂和新键的生成
D.复分解反应一般不发生能量转化
参考答案:C
本题解析:
本题难度:简单