微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 释放或吸收热量是化学反应中能量变化的主要形式之一。则下列有关说法不正确的是
A.生命体中糖类与氧气的反应、生产和生活中燃料的燃烧等都是反应热效应的重要应用
B.能源是可以提供能量的自然资源,包括化石燃料、阳光、风力、流水、潮汐等
C.一个化学反应是吸收能量还是放出能量,取决于反应物总能量和生成物总能量的相对大小
D.在化学反应过程中,只要反应物和生成物具有相同温度,反应所吸收或放出的热量就称为化学反应的焓变
2、选择题 对于反应3A==2B,根据下图,说法不正确的是(?)
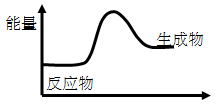
A.该反应为吸热反应
B.该反应一定有能量转化成了化学能
C.反应物比生成物稳定
D.因为生成物的总能量高于反应物的总能量,所以该反应不需要加热
3、选择题 下列关于能量转换的认识中不正确的是
[? ]
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.煤燃烧时,化学能主要转化为热能
D.白炽灯工作时,电能全部转化为光能
4、填空题 某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 ? g。?
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): ? 。?
名称
| 托盘天平
(带砝码)
| 小烧杯
| 坩埚钳
| 玻璃棒
| 药匙
| 量筒
|
仪器
| 
| 
| 
| 
| 
| 
|
序号
| a
| b
| c
| d
| e
| f
|
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
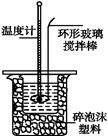
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) ? ? ? ?。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
温度
实验次数
| 起始温度t1/℃
| 终止温度t2/℃
| 温度差
平均值
(t2-t1)/℃
|
H2SO4
| NaOH
| 平均值
|
1
| 26.2
| 26.0
| 26.1
| 29.6
| ?
|
2
| 27.0
| 27.4
| 27.2
| 31.2
| ?
|
3
| 25.9
| 25.9
| 25.9
| 29.8
| ?
|
4
| 26.4
| 26.2
| 26.3
| 30.4
| ?
|
?
①上表中的温度差平均值为 ?℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c="4.18" J·(g·℃)-1。则中和热ΔH= ?(取小数点后一位)。?
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。?
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
5、选择题 有关下列图象说法正确的是( )

A.由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小
B.图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系
C.图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响.可知反应物N2的转化率最高的是b点;T1>T2,K2>K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数)
D.图4表示25℃时,用0.1?mol?L-1盐酸滴定20?mL?0.1?mol?L-1氨水的pH随加入盐酸体积的变化