微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 烧杯中盛有100 mL 1 mol/L的NaHSO4溶液,向其中逐滴滴加1 mol/L的Ba(OH)2溶液,烧杯中某些物质(或微粒)的物质的量的变化曲线如图。下列说法中正确的是( )
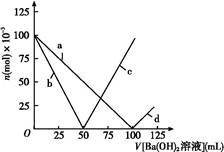
A.曲线a表示Ba2+的物质的量的变化
B.曲线c表示OH-的物质的量的变化
C.加入Ba(OH)2溶液50 mL反应的离子方程式为Ba2++OH-+H++SO42— BaSO4↓+H2O
BaSO4↓+H2O
D.加入Ba(OH)2溶液大于50 mL后,反应的离子方程式为OH-+H+ H2O
H2O
参考答案:B
本题解析:起始n(NaHSO4)="0.1" mol,即n(Na+)="0.1" mol[反应前后n(Na+)不变,所以曲线不对应Na+],n(H+)="0.1" mol,n(SO42—)="0.1" mol,加入Ba(OH)2溶液后,SO42—、H+要减少,加入Ba(OH)2溶液50 mL时,即n[Ba(OH)2]="0.05" mol,此时H+中和完,所以曲线b表示H+的变化,SO42—反应一半,当加入Ba(OH)2溶液大于50 mL时,OH-开始增多,所以曲线c表示OH-的变化,当加入Ba(OH)2溶液100 mL时,SO42—沉淀完,所以曲线a表示SO42—的变化,加入Ba(OH)2溶液大于100 mL时,Ba2+开始增多,所以曲线d表示Ba2+的变化,加入Ba(OH)2溶液50 mL 时,反应的H+与SO42—的物质的量之比为2∶1,所以离子方程式为:Ba2++2OH-+2H++SO42— 2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42—
2H2O+BaSO4↓,大于50 mL 时,H+已反应完,反应为Ba2++SO42— BaSO4↓。
BaSO4↓。
本题难度:一般
2、选择题 下列文字表述与反应方程式对应且正确的是(?)
A.实验室用液溴和苯在催化剂作用下制溴苯: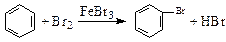
B.用醋酸除去水垢:CaCO3 + 2H+==Ca2+ + H2O + CO2↑
C.钢铁的吸氧腐蚀正极反应:4OH-? + 4e- ="=" O2↑+ 2H2O
D.+4价硫元素表现出还原性:H2SO3十2H2S==3S↓+3H2O
参考答案:A
本题解析:略
本题难度:简单
3、简答题 现有下列十种物质:①Cu(OH)2?②干冰?③Cu?④纯碱⑤BaCl2⑥Ca(OH)2?⑦稀硝酸?⑧盐酸?⑨A12(SO4)3?⑩KHSO4
(1)按物质的分类方法填写表格的空白处(填写序号):
写出④在水中的电离方程式为______.
(2)写出下列物质相互之间反应的离子方程式:⑤+⑨______
②(过量)通入浑浊的⑥溶液后变澄清______
(3)经测定0.1mol/L⑩的水溶液与0.1mol/L⑧中的氢离子浓度基本相同,往固体①中加入过量的0.1mol/L⑩的水溶液,发生反应的离子方程式是______.
(4)③与⑦发生反应的化学方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,当有19.2gCu发生反应时,转移电子的物质的量为______mol,产生的NO在标准状况下的体积为______L.
参考答案:(1)氧化物为由两种元素组成的化合物,且有一种元素为氧元素,属于氧化物的是②,非电解质是在熔融状态下和溶液中都不导电的化合物,属于非电解质的是②,
纯碱为强电解质,在溶液中完全电离生成Na+和CO32-,电离方程式为Na2CO3=2Na++CO32-,
故答案为:分类标准氧化物非电解质属于该类的物质②②Na2CO3=2Na++CO32-;
(2)⑤+⑨反应生成沉淀,反应的离子方程式为Ba2++SO42-=BaSO4↓,
②(过量)通入浑浊的⑥溶液后变澄清,反应的离子方程式为Ca(OH)2+CO2=Ca2++HCO3-+H2O,
故答案为:Ba2++SO42-=BaSO4↓;Ca(OH)2+CO2=Ca2++HCO3-+H2O;
(3)往固体①中加入过量的0.1mol/L⑩的水溶液,反应的离子方程式为Cu(OH)2+2H+=Cu2++2H2O,
故答案为:Cu(OH)2+2H+=Cu2++2H2O;
(4)n(Cu)=19.2g64g/mol=0.3mol,
转移电子的物质的量为:0.3mol×2=0.6mol,
由方程式可知:n(NO)=23×n(Cu)=0.2mol,
V(NO)=0.2mol×22.4L/mol=4.48L.
本题解析:
本题难度:一般
4、填空题 用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是______
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是______
(3)D是由两种元素组成的三原子分子,电子式是______
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式______
(5)E+F→C+D写出该方程式______.
参考答案:含有10个电子的微粒有:CH4、NH3、H2O、HF、NH4+、OH-、H3O+、O2-、F-、Na+、Mg2+、Al3+等,则
(1)A离子为单核离子且A原子在所在周期中原子半径最大,则A为Na元素,A离子是Na+,故答案为:Na+;
(2)由两种元素组成的分子,其水溶液呈碱性的物质是NH3,故答案为:NH3;
(3)由两种元素组成的三原子分子为H2O,其电子式为
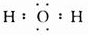
,故答案为:
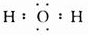
;
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,则B为Al3+,F为OH-,反应的离子方程式分别有:
Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+H2O,
故答案为:Al3++3OH-=Al(OH)3↓,Al(OH)3+OH-=AlO2-+H2O;
(5)由以上分析可知E为NH4+,F为OH-,C为NH3,D为H2O,反应的离子方程式为NH4++OH-=NH3+H2O,
故答案为:NH4++OH-=NH3+H2O.
本题解析:
本题难度:一般
5、选择题 下表是有关反应的离子方程式及对方程式的评价,其中方程式书写及对方程式正误评价均正确的是
编号
| 化学反应
| 离子方程式
| 评价
|
A
| 向NaHCO3 溶液中加入少量Ca(OH)2溶液
| HCO3-+OH-+ Ca2+ = CaCO3 ↓+H2O
| 正确
|
B
| 少量SO2通入
Ba(NO3)2溶液
| 3SO2+2NO3-+3Ba2++2H2O===3BaSO4 ↓+2NO ↑+4H+
| 错误
|
C
| 水杨酸与少量Na2CO3反应
| 
| 错误
|
D
| H218O2中加入酸性高锰酸钾溶液
| 5H218O2 + 2MnO4- + 6H+=2Mn2+ + 518O2↑+8H2O
| 正确
参考答案:D
本题解析:A、少量的Ca(OH)2,故完全反应,Ca2+:OH-=1:2;错误;
B、该离子反应方程式正确;
C、酚羟基也能发生反应,生成碳酸氢根;
本题难度:一般
|