微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
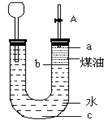
1、选择题 按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是?(?)
A.
 打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的 实验现象是钠在b处液面以下的水中反应
实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
参考答案:C
本题解析:略
本题难度:一般
2、实验题 (10分)成都七中文艺青年小组进行了关于“活泼金属与酸反应”的实验,得出了一些有趣的想法,请你帮助他们,完成一些判断。将5.4g铝片投入500mL 0.5 mol·L-1的硫酸溶液中,下图为反应产氢速率与反应时间的关系图。
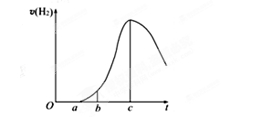
(1)关于图像的描述不正确的是_③_____(2分)
①a→c段产生氢气的速率增加较快可能是表面的氧化膜逐渐溶解,加快了反应的速率
②a→c段产生氢气的速率增加较快可能是该反应放热,导致温度升高,加快了反应
③c以后,产生氢气的速率逐渐下降可能是铝片趋于消耗完全
(2)书写O→a段所对应的离子方程式____________________________________(2分)
(3)若其他条件不变,现换用500mL1mol·L-1盐酸,产生氢气速率普遍较使用500mL 0.5mol·L-1硫酸的快,可能的原因是_②④_______(2分)
①盐酸中c(H+)的浓度更大?②Cl—有催化作用?③SO42—有催化作用
④SO42—有阻化作用?⑤Al3+有催化作用
(4)根据所学,若要加快铝片与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:①加入某种催化剂;②滴加少量CuSO4溶液;③将铝片剪成100条;④增加硫酸的浓度至18mol/L;⑤加入蒸馏水;⑥加入少量KNO3溶液;⑦_____________。(2分)
其中,你认为不合理的方案有_____________(2分),并请你再补充一种合理方案,填入空白⑦处。
参考答案:(1)③(2分)?(2)Al2O3+6H+="2" Al3++3H2O(2分)?
(3)②④(2分)?(4)⑦升高温度(2分)?④⑤⑥(2分)
本题解析:(1)在反应的后期,由于硫酸的浓度逐渐降低,导致反应速率逐渐降低。铝是固体,其质量多少不能影响反应速率,所以③是错误的,其余都是正确的,答案选③.
(2)铝是活泼的金属极易被氧化生成一层致密的氧化膜,所以开始没有氢气此时,是因为硫酸和氧化铝反应导致的,方程式为Al2O3+6H+="2" Al3++3H2O。
(3)根据浓度可知氢离子的浓度是相同的,所以①不正确,反应中都生成铝离子,④不正确。由于酸中阴离子是不同的,盐酸反应快,这说明Cl—有催化作用,或者是SO42—有阻化作用,答案选②④。
(4)考查外界条件对反应速率的影响。一般增大反应物的浓度、升高温度、或加入催化剂、或提高原电池反应、或增大反应物的接触面积等都能加快反应速率。浓硫酸和铝不能产生氢气,④不正确,⑤是稀释降低氢离子浓度,反应速率降低。在酸性溶液中,硝酸钾能和铝反应但产生的气体是NO,而不是氢气,所以⑥不正确。
本题难度:一般
3、填空题 某研究性学习小组在CO还原Fe2O3的实验中,用磁铁吸出生成的黑色粉末X,他们认为X不一定是Fe,若温度不均时会生成Fe3O4,也能被磁铁吸引。为了探究X的组成,他们进行了如下实验。
I、定性检验
实验编号
| 实验操作
| 实验现象
|
①
| 取少量黑色粉末X放入试管1中,注入浓盐酸,微热
| 黑色粉末逐渐溶解,溶液呈黄绿色,有少量气泡产生
|
②
| 另取少量黑色粉末X放入试管2中,注入足量硫酸铜溶液,振荡,静置
| 有极少 量红色物质析出,仍有较多黑色固体未溶解 量红色物质析出,仍有较多黑色固体未溶解
|
?
由上述实验现象推断,黑色粉末X的成分是?。
II、定量测定
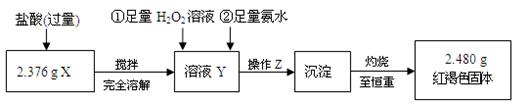
⑴ 操作Z的名称是?,如图19的仪器中,在灼烧沉淀时必须用到的是?(填字母)。

⑵ 写出溶液Y中滴加H2O2溶液时发生反应的离子方程式:
?。
⑶ 将沉淀物加热,并置于干燥器中冷却至室温,用托盘天平称量其质量为b1 g,再次加热并冷却至室温称量其质量为b2 g,若b1- b2= 0.3 g,则接下来还应进行的操作是?
?。
⑷ 有同学认为:上述流程若不加入H2O2,其它步骤不变,只要在空气中充分放置仍可达到目的。他的理由是(用化学方程式表示):
?。
⑸ 通过以上数据,得出2.376 g黑色粉末中各成分的物质的量为?。
参考答案:Ⅰ? Fe 、 Fe3O4
Ⅱ? ⑴ 过滤、洗涤 (只选过滤得1分)? A C E F?
⑵ 2Fe2+ + H2O2+ 2H+===?2Fe3+ 2H2O?
⑶ 再次加热并置于干燥器中冷却,称量,直至两次的质量差不超过0.1g为止。
⑷ 4Fe(OH)2+ O2+ 2H2O ===?4Fe(OH)3 ?
⑸ n(Fe) = 0.001 mol? n(Fe3O4) = 0.01? mol
本题解析:略
本题难度:一般
4、填空题 (5分)图中A-D是中学化学实验中常见的几种温度计装置示意图。

(1)请从①~⑧中选出必须使用温度计的实验,把编号填入A~C的横线中(多选要倒扣分)。
A ??B ??C ?.
①酒精和浓硫酸混合加热制乙烯? ②电石跟水反应制乙炔?
③分离苯跟硝基苯的混合物? ④苯跟溴的取代反应?
⑤石油分馏实验? ⑥浓盐酸和二氧化锰混合加热制氯气
⑦测定硝酸钾在水中的溶解度? ⑧食盐和浓硫酸混合加热制氯化氢
(2)选用装置D做苯的硝化实验,D中长玻璃管的作用是:?。
参考答案:(1)A① (1分)? B.③⑤ (2分)? C.⑦ (1分)
(2)减少苯的挥发(或“起冷凝器作用”)(1分)
本题解析:(1)①实验室制乙烯温度控制170度,温度计水银球在反应物液面下,对应A;
②电石跟水反应制乙炔,不需要加热;
③利用沸点不同,通过加热,控制蒸汽温度,分馏各组分,温度计水银球在蒸馏烧瓶支管口处,对应为B;
④苯和溴的取代反应,不需要加热;
⑤利用沸点不同,通过加热,控制蒸汽温度,分馏各组分,温度计水银球在蒸馏烧瓶支管口处,对应为B;
⑥浓硫酸和二氧化锰混合加热制氯气,不需要控制温度;
⑦测定硝酸钾在水中的溶解度,要控制移动温度,温度计水银球在液面下,对应为C;
⑧盐和浓硫酸混合加热制氯化氢,不需要控制温度;
故答案为:A①;B③⑤;C ⑦
(2)苯易挥发,所以D中长玻璃管的作用起冷凝器作用,减少苯的挥发.
故答案为:起冷凝器作用,以减少苯的挥发
点评:本题关键是在辨析各个反应的实验装置中温度计的位置,实际上在辨析各个反应的反应条件,所收集产物的性质,本题是一道非常好的实验题。
本题难度:一般
5、选择题 将下列各组物质区别开来的实验方案(见括号内的方法)不合理的是( )
A.Na2CO3和NaHCO3(采用加氯化钙溶液观察有无沉淀的方法)
B.(NH4)2SO4与NH4Cl(采用加氢氧化钠溶液并加热闻其气味的方法)
C.NaCl与KCl(采用灼烧时观察焰色的方法)
D.K2CO3与KNO3(采用加稀盐酸观察有无气泡产生的方法)
参考答案:A、碳酸钠可以和氯化钙反应生成白色沉淀碳酸钙,但是碳酸氢钠和氯化钙不反应,故A正确;
B、所有的铵盐和强碱共热均会生成氨气,无法鉴别两种物质,故B错误;
C、钠离子和钾离子的检验可以通过焰色反应法来确定,含有钠元素的物质焰色反应是黄色的,含有钾元素的物质焰色反应是紫色的,故C正确;
D、碳酸钾可以和盐酸反应生成二氧化碳,但是硝酸钾和盐酸不反应,现象不一样,可以鉴别,故D正确.
故选B.
本题解析:
本题难度:简单