微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式正确的是
A.CuSO4溶液吸收H2S气体:
B.Ca(HCO3)2溶液和少量的NaOH溶液混合:→CaCO3↓+
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:Fe2++2H++H2O2→Fe2++2H2O
D.淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O→
参考答案:AD
本题解析:分析:A.反应生成CuS和硫酸;
B.少量的NaOH溶液完全反应,反应生成碳酸钙、水、碳酸氢钠;
C.发生氧化还原反应生成硫酸铁和水;
D.发生氧化还原反应生成碘和KOH.
解答:A.CuSO4溶液吸收H2S气体的离子反应为Cu2++H2S═CuS↓+SO42-,故A正确;
B.Ca(HCO3)2溶液和少量的NaOH溶液混合的反应为Ca2++HCO3-+OH-=CaCO3↓+H2O,故B错误;
C.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液的离子反应为2Fe2++2H++H2O2═2Fe3++2H2O,故C错误;
D.淀粉碘化钾溶液在空气中变蓝的离子反应为4I-+O2+2H2O═I2+4OH-,故D正确;
故选AD.
点评:本题考查离子反应的书写,明确发生的化学反应把握化学反应的实质是解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.
本题难度:一般
2、选择题 符合如图所示的转化关系,且当X、Y、Z的物质的量相等时,存在焓变△H=△H1+△H2。满足上述条件的X、Y可能是( )
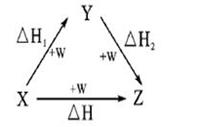
①C、CO ②S、SO2 ③Na、Na2O
④AlCl3、Al(OH)3 ⑤Fe、Fe(NO3)2 ⑥NaOH、Na2CO3
A.①④⑤ B.①②③ C.①③④ D.①③④⑤⑥
参考答案:A
本题解析:右图所示的含义是指化学反应的能量与反应过程无关,只与始终态有关,即盖斯定律,则X→Z的反应可看成X→Y的反应与Y→Z的反应之和。①X、Y是C、CO ,则Z是二氧化碳,符合此图,正确;②X、Y是S、SO2 ,则Z不能是三氧化硫,因为S不能直接生成三氧化硫,错误;③X、Y是Na、Na2O ,Na生成 1molNa2O时需要2molNa,所以当X、Y、Z的物质的量相等时,不存在焓变△H=△H1+△H2,错误;④X、Y是AlCl3、Al(OH)3,则Z是NaAlO2,符合此图,正确; ⑤X、Y是Fe、Fe(NO3)2则Z是Fe(NO3)3,符合此图,正确; ⑥X、Y是NaOH、Na2CO3,则Z是NaHCO3,生成1mol Na2CO3与NaHCO3时消耗NaOH的物质的量不相等,所以当X、Y、Z的物质的量相等时,不存在焓变△H=△H1+△H2,错误,答案选A。
考点:看成对盖斯定律的理解
本题难度:一般
3、选择题 下列物质中,只含有非极性共价键的是(?)
A.Na2O
B.H2O
C.Cl2
D.NH3
参考答案:C
本题解析:一般活泼的金属和活泼的非金属容易形成离子键,非金属元素的原子间容易形成共价键,据此可知选项A中只有离子键,B中只有极性键,C中只有非极性键,D中只有极性键,答案选C。
点评:该题是高考中的常见考点,属于基础性试题的考查,试题基础性强,侧重对学生基础知识的训练,主要是考查学生灵活运用化学键知识解决实际问题的能力。该题的关键是明确离子键、共价键的含义和判断依据,然后结合题意灵活运用即可。
本题难度:一般
4、选择题 某元素的原子最外层只有一个电子,它跟氯元素结合时( )
A.一定形成共价键
B.一定形成离子键
C.可能形成共价键,也可能形成离子键
D.以上说法都不对
参考答案:因某元素的原子最外层只有一个电子,该元素可能为H,也可能为碱金属,
若为H元素,跟氯元素结合为HCl,含有共价键;
若为碱金属,金属失去电子变为离子,H得电子变为阴离子,形成离子键;
则可能形成共价键,也可能形成离子键,
故选C.
本题解析:
本题难度:一般
5、选择题 下列变化过程放热的是

A.H2O(l)→H2O(g)
B.2HI(g)→H2(g)+I2(g)+QQ=—14.9 kJ/mol
C.形成化学键时共放出能量862 kJ的化学反应
D.能量变化如上图所示的化学反应