|
高考化学知识点整理《电解池原理》答题技巧(2017年最新版)(十)
2017-08-08 05:22:10
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH +2H2O Cd(OH)2 +2Ni(OH)2 有关该电池的说法正确的 Cd(OH)2 +2Ni(OH)2 有关该电池的说法正确的
[? ]
A.充电过程是化学能转化为电能的过程
B.放电时负极附近溶液的碱性不变
C.放电时电解质溶液中的OH-向正极移动
D.充电时阳极反应:Ni(OH)2-e-+OH-= NiOOH+H2O
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列关于铜电极的叙述不正确的是
A.铜锌原电池中铜是正极
B.用电解法精炼铜时粗铜作阳极
C.在镀件上镀铜时可用铜作阳极
D.电解稀硫酸溶液制H2、O2时铜做阳极
|
参考答案:D
本题解析:A、锌比铜活泼,所以铜锌原电池中铜是正极,正确;B、用电解法精炼铜时粗铜作阳极,发生氧化反应,纯铜作阴极,发生还原反应得到单质铜,正确;C、电镀时,镀层金属作阳极,镀件作阴极,所以在镀件上镀铜时可用铜作阳极,正确;D、电解稀硫酸溶液制H2、O2时,若铜做阳极,则在阳极放电的是活性电极Cu,不是氢氧根离子,所以得不到氧气,错误,答案选D。
考点:考查原电池、电解池、电镀池的反应中Cu极作用的判断
本题难度:一般
3、填空题 25.(12分)发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1 N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g) ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g) ΔH =" +23.4" kJ·mol-1 NH3(g) ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
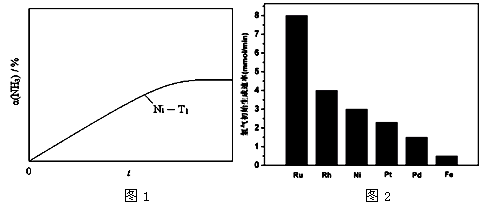
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
(已知:液氨中2NH3(l)  NH2- + NH4+) NH2- + NH4+)
参考答案:(1) 高温
(2) -1172.4 kJ·mol-1
(3) ①Fe
② 见图曲线Ru-T1
③ 见图曲线 Ru-T2

(4) 2NH3 + 2e-= H2 + 2NH2- (或2NH4++2e-= H2 +2NH3)
本题解析:(1)高温有利于正反应的发生,可促进氨气的自发分解;(2)2NH3(g)  N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l) N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l) NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。 NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
考点:热化学方程式及相关计算、电极方程式的书写
点评:本题较有难度,关键是要掌握热化学方程式的计算和电极方程式的书写。
本题难度:困难
4、填空题 O3可由臭氧发生器(原理如图)电解稀硫酸制得。
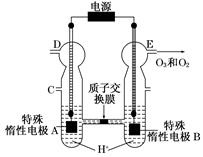
(1)图中阴极为?(填“A”或“B”),其电极反应式为?。
(2)若C处通入O2,则A极的电极反应式为?。
(3)若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为?(忽略O3的分解)。
参考答案:(1)A 2H++2e-=H2↑
(2)O2+4H++4e-=2H2O
(3)(x-2y)/y
本题解析:观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H++2e-=H2↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O2+4H++4e-=2H2O;设y L混合气体中臭氧的体积分数为a,由电子守恒有2x=y a×6+y (1-a)×4,解得a=(x-2y)/y。
本题难度:一般
5、选择题 用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1,且电解后溶液的pH增大的是
A.KCl
B.NaOH
C.Na2SO4
D.H2SO4
参考答案:B
本题解析:用石墨作电极,电解下列溶液,阴、阳两极均产生气体,其体积比为2:1可以说明电解的过程实际是在电解水。KCl溶液中氯离子会失去电子,A错误;B、C、D三种物质实际都是电解水,NaOH溶液随着电解的进行溶液的PH增大,Na2SO4溶液随着电解的进行溶液依旧是中性,PH不变,H2SO4溶液随着电解的进行溶液的PH变小,所以答案选B。
本题难度:一般
|