微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 过氧化氢(H2O2)俗名双氧水,医疗上可做外科消毒剂。
(1)H2O2的电子式为______。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫色消褪了,此时双氧水表现出_______性。若MnO4-的产物为Mn2+,该反应的离子方程式为______。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关的反应方程式为______。此时双氧水表现出______性。
参考答案:(1)? ; (2)还原性,5H2O2+2MnO4-+6H+====2Mn2++5O2↑+8H2O;(3)4H2O2+PbS====PbSO4+4H2O,氧化性。
; (2)还原性,5H2O2+2MnO4-+6H+====2Mn2++5O2↑+8H2O;(3)4H2O2+PbS====PbSO4+4H2O,氧化性。
本题解析:H2O2中氧为-1价,处于0价与-2价之间,所以H2O2既有氧化性,又有还原性。因-1价不稳定,倾向于再得一个电子变成-2价氧,所以H2O2主要的性质是强氧化性。这是过氧化物的基本性质。
本题难度:一般
2、选择题 将足量的SO2通入BaCl2溶液中,无明显现象,当加入一试剂X后有沉淀生成。此试剂X不可能是:①CO2②氯水?③氨水④H2S?⑤NO2?⑥ AgNO3?(?)
A.①③
B.①
C.①⑤
D.①④
参考答案:B
本题解析:①不可能,加入CO2溶液还是显酸性,无沉淀生成;②可以,加入氯水,能将+4价S氧化为硫酸根离子从而可形成硫酸钡沉淀;④正确,加入H2S会与SO2反应生成S沉淀;⑤正确,通入NO2能氧化二氧化硫成硫酸根离子,从而有硫酸钡沉淀生成;⑥可以,加入 AgNO3溶液有氯化银沉淀生成;
本题难度:一般
3、实验题 (15分)为研究硫酸的性质,研究性学习小组设计以下两个实验。实验一:检查好装置的气密性后,在如图一所示甲的试管中加入足量的Fe合金(含有一定量的C),然后,加入少量浓硫酸。
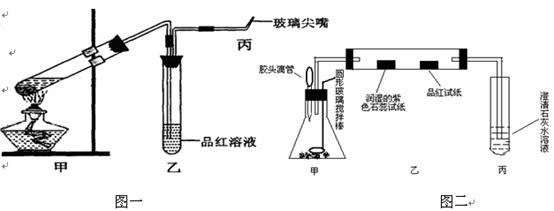
图一?图二
①.在未点燃酒精灯时,乙中没有明显现象,这是因为________________________?
为处理生成的有毒气体,还应在乙、丙之间接入干燥管,并在其中填充足量的?。
②.反应开始一段时间后,在丙处检验到某种无色无味气体,它是__________。
若甲中加入的是纯铁,丙处产生气体的速率没有前者的快,这是因为____________
实验二:
高一必修教材《浓硫酸与蔗糖反应的实验》这个传统实验是在敞口容器中进行,药品用量大,且浓硫酸与蔗糖反应过程中生成大量有毒气体直接排放到空气中,不符合“绿色化学”的新理念;对此实验进行新的设计和改进:取少量的蔗糖置于锥形瓶中加入几滴水,用胶头滴管滴加几滴浓硫酸,通过圆形玻璃搅拌棒不断搅拌;如上图二所示观察:
①.白色的蔗糖发黄再变黑,这是因为浓硫酸具有?性;一会儿迅速变成蜂窝状(形似“黑馒头” );写出发生的化学方程式:?
②.紫色石蕊试纸变红,品红试纸褪色,澄清石灰水出现浑浊,该小组同学认为有二氧化碳生成,你是否赞成此观点;若赞成就不填写;若不赞成,你将如何改进才能证明有二氧化碳生成:?
③.另一小组将紫色石蕊试纸更换为少许无水硫酸铜,结果没有观察到无水硫酸铜变蓝,证明浓硫酸具有??;
参考答案:实验一
①常温下,Fe遇浓硫酸钝化(1分),而C不与浓硫酸反应(1分); ?碱石灰(2分)
②氢气(或H2)(1分)?形成原电池加快反应速率?(2分)
实验二
①?脱水性 (2分) , C+2H2SO4(浓)  CO2↑+2SO2↑+2H2O?(2分)
CO2↑+2SO2↑+2H2O?(2分)
②在乙与丙之间增加酸性KMnO4除SO2? ,再用品红溶液检验SO2是否除尽
(2分,合理答案均给分)
③?吸水性 (2分)
本题解析:略
本题难度:一般
4、选择题 将SO2气体徐徐通入悬浮着棕色PbO2的热水中,一段时间后,将发生的现象是
A.悬浮物消失,溶液无色
B.悬浮物由棕色变白色
C.有臭鸡蛋气味的气味逸出
D.析出浅黄色沉淀
参考答案:B
本题解析:
铅的+2价化合物稳定,故PbO2具有强氧化性,易得电子发

在溶液中的反应为Pb2+?+SO42-=PbSO4↓(白色)。
本题难度:一般
5、选择题 把1 g含脉石(SiO2)的黄铁矿样品放在O2流中灼烧,反应完全后得到残渣0.78 g,则此黄铁矿的纯度是…()
A.33%
B.66%
C.78%
D.88%
参考答案:B
本题解析:利用差量法求解。
4FeS2+11O2 2Fe2O3+8SO2 ~Δm
2Fe2O3+8SO2 ~Δm
4×120? 160
m(FeS2)? 1 g-0.78 g
m(FeS2)="0.66" g
FeS2的纯度为: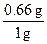 ×100%=66%
×100%=66%
本题难度:简单