微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 新制氯水中含有多种粒子,某校化学研究性学习小组的同学为探究其性质,做了如下实验,请你帮助完成:
(1)HClO不稳定,见光易分解生成HCl和O2。请设计实验证明有O2生成?。
(2)氯气能使湿润的红色布条退色。对于使湿润的红色布条退色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请你设计实验,得出正确结论。
提出问题
| 收集资料
| 提出假设
| 验证假设
| 得结论出
|
氯水中何种物质能使湿润的红色布条退色?
| ①氯气有强氧化性
②氯气与冷水反应生成盐酸和次氯酸
③次氯酸有强氧化性
| ①?
②?
③?
④H2O使布条退色
| ①:实验①:把红色干布条放入充满氯气的集气瓶中,布条不退色
实实验②:?;
实验③:把红色布条放在水里,布条不退色
| ?
|
?
2、填空题 氯是重要的非金属元素。
30.NaCl和浓硫酸微热制取氯化氢的化学方程式为?;
可用?试纸放在瓶口以检验氯化氢气体是否集满。
31.新制氯水中含有的分子有:Cl2、H2O和?;光照新制氯水的化学方程式为?;工业是用电解食盐水制取氯气,阴极的电极反应式为:
2H++2e→H2↑,则阳极的电极反应式为?。
32.已知还原性SO32->I->Br-.向NaBr、NaI、Na2SO3混合溶液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是______(选填编号)。
a. NaCl? Na2SO4? b.? NaCl? NaBr? Na2SO4
c. NaCl? Na2SO4? I2? d.? NaCl? NaI? Na2SO4
3、计算题 将2.80 g CaO与500 mL某浓度的盐酸充分反应,将所得溶液平均分成两份。向其中一份中加入足量的AgNO3溶液,生成的沉淀干燥后的质量为14.4 g;向另一份溶液中加入足量Zn粒,产生0.560 L(标准状况)气体。计算所用盐酸中HCl的物质的量浓度。
4、选择题 下列物质能通过化合反应直接制得的是( )
①FeCl2?②H2SO4?③NH4Cl?④NO.
A.只有①②③
B.只有②③④
C.只有①③④
D.全部
5、简答题 实验一、定性探究:
①在试管中加入过量的块状碳酸钙,再加入约20mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.
经检测,上述实验中产生的无色气体均为CO2.请回答:
(1)试解释可以在饱和氯水中加入石灰石制备HClO的原因______.
(2)写出步骤③中第一份及第二份滤液发生反应的离子方程式:
第一份:______.
第二份:______.
(3)试根据所学知识推测,在②的滤液中含?有的溶质,除了溶解的极少量氯气外,还含有的其它溶质为(写化学式)______.
实验二、定量探究:
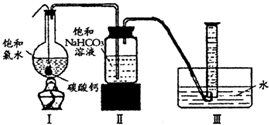
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150mL饱和氯水,按如右图所示装置(部分夹持、支撑仪器没有画出)实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加.请回答:
(4)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,水槽中的水应换为______.
A.饱和碳酸钠溶液?B.饱和碳酸氢钠溶液?C.饱和食盐水
(5)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现
明显小于.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是______.