微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 CH4和C2H4的混合气体共2.24L(标准状况下),缓缓通过足量的溴水,充分吸收后,测得溴水增重1.12g,则乙烯占混合气体体积的
A.40%
B.20%
C.80%
D.60%
参考答案:A
本题解析:分析:CH4和C2H4的混合气体,通过足量的溴水充分吸收后,溴水增重1.12g为C2H4质量,根据n=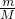 计算C2H4物质的量,再利用v=nVm计算C2H4体积,最后利用体积分数定义计算.
计算C2H4物质的量,再利用v=nVm计算C2H4体积,最后利用体积分数定义计算.
解答:CH4和C2H4的混合气体,通过足量的溴水充分吸收后,溴水增重1.12g为C2H4质量,
所以n(C2H4)=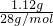 =0.04mol.
=0.04mol.
所以C2H4的体积为0.04mol×22.4L/mol=0.4×2.24L.
所以C2H4的含量为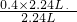 ×100%=40%.
×100%=40%.
故选:A.
点评:考查混合物的有关计算及烯的性质,难度不大,关键明白烯与溴发生加成反应,甲烷与溴水不反应.
本题难度:简单
2、选择题 下列各组离子,在酸性溶液中能大量共存的是
A.SO42-、I-、ClO-、Na+
B.Na+、AlO2-、Cl-、K+
C.Mg2+、SO42-、Cl-、Al3+
D.NO3-、Ag+、NH4+、I-
参考答案:C
本题解析:分析:酸性溶液中含大量的H+,根据离子之间不能结合生成水、气体、沉淀、弱电解质,不能发生氧化还原反应等,则离子能大量共存,以此来解答.
解答:A.I-、ClO-、H+发生氧化还原反应,则不能共存,故A错误;
B.H+、AlO2-结合生成沉淀,则不能共存,故B错误;
C.因该组离子之间不反应,能共存,故C正确;
D.因Ag+、I-结合生成沉淀,NO3-、H+、I-发生氧化还原反应,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确酸性溶液及离子之间的反应即可解答,注意发生的氧化还原反应为解答的难点,题目难度中等.
本题难度:简单
3、选择题 下列各组溶液,在现有知识范围内只能通过焰色反应鉴别的是
A.NaNO3? KCl
B.Na2SO4 ?K2CO3
C.KNO3? NaHSO4
D.NaCl? ?KCl
参考答案:D
本题解析:在现有知识范围内,A、B、C三组都可通过阴离子鉴别,唯D组阴离子相同,而阳离子无合适的试剂加以区别。
本题难度:简单
4、选择题 将充满NO2和O2的量筒倒立于盛有水的水槽中,经过一段时间后,水上升到量筒体积的一半处停止了,则剩余气体的成份是
A.NO2
B.NO
C.O2
D.NO或O2
参考答案:C
本题解析:设试管的总容积为1,如果余下的1/2全是NO,则NO2必须过量3/2,这已经超出了试管的总容量,这是不可能的,故余下的气体只能是O2。
本题难度:一般
5、选择题 已知:NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
A.x的最小值为110
B.x的最小值为100
C.所加盐酸物质的量浓度为1.0mol/L
D.样品A中NaHCO3和Na2CO3·nH2O的物质的量分别为0.090mol和0.010mol
参考答案:B
本题解析:该题考查知识点为有关溶液物质的量浓度的计算。若纯粹考查计算会比较单一,结合反应和对数据的分析考查能体现学生分析问题的能力。
由表中数据,加入8 mL盐酸时没有二氧化碳气体生成,说明样品中含有Na2CO3·nH2O。发生反应的方程式为:Na2CO3·nH2O+HCl= NaHCO3+NaCl+nH2O…①,NaHCO3+HCl=CO2↑+NaCl+H2O…②。当加入15mL盐酸时生成112 mLCO2气体,当加入20mL盐酸时生成224 mLCO2气体,可得出当Na2CO3·nH2O与HCl完全生成NaHCO3之后,每加入5mL盐酸就生成112 mLCO2气体;由此可得出当样品中开始加入10mL盐酸时只发生反应①,当生成2240mLCO2时,对应100mL盐酸,再加上开始时加入的10mL,可得当生成2240mLCO2时,加入的盐酸的总体积为110mL,该体积即为生成2240mLCO2时的最小值。标况下2240mLCO2的物质的量为0.1mol,由反应②可得消耗NaHCO3的物质的量为0.1mol,消耗HCl的物质的量为0.1mol,该反应中消耗HCl的体积为100mL,则盐酸的物质的量浓度为1.0 mol/L。反应①中消耗HCl的体积为10mL,其物质的量为0.01mol,所以Na2CO3·nH2O的物质的量为0.01mol,同时生成0.01molNaHCO3,所以样品中NaHCO3的物质的量为0.1mol-0.01mol=0.09mol。
本题难度:简单