微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
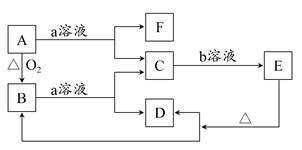
1、填空题 在下图所示转化关系中,A是一种固体单质,E是一种白色沉淀,F为密度最小的无色气体。且各种物质所含元素除H、O外,其余均为第三周期元素。
请按要求回答下列问题:
(1)若实现C→E转化所需的b溶液是“过量的盐酸”,则B的化学式为________。
(2)若实现C→E转化所需的b溶液不能使用“过量的盐酸”,只能使用“少量的盐酸”,则C的溶液显________(填“酸”“碱”或“中”)性;A和a溶液反应,若产生标准状态下3.36 L的F气体,转移的电子数目为________。
(3)若实现C→E转化所需的b溶液是“过量的NaOH溶液”,则E的化学式为________;反应B+a→C+D的离子方程式为___________________________。
参考答案:(1)SiO2 (2)碱 1.806×1023
(3)Mg(OH)2 MgO+2H+=Mg2++H2O
本题解析:(1)加过量盐酸生成的白色沉淀在第三周期元素构成的化合物只有H2SiO3,所以B为SiO2。
(2)若实现C→E转化所需的b溶液不能使用“过量的盐酸”,只能使用“少量的盐酸”,则C应为NaAlO2溶液显碱性。当生成标准状况下3.36 L H2时转移电子数为0.3×6.02×1023个。
(3)若实现C→E转化所需b溶液为“过量的NaOH溶液”,则E为Mg(OH)2,B与a反应的离子方程式为:MgO+2H+=Mg2++H2O。
本题难度:一般
2、填空题 (14分)A为单质,B、C、D、E为与A含有相同元素的化合物,它们之间有如下转化关系:
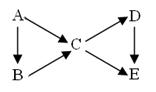
(1)若上图中B、C均为氧化物、D、E均为盐,则A可能是__________。
①Na? ②N2 ?③C? ④S?
(2)若五种物质的焰色反应均为黄色,其中C、D、E的水溶液均显碱性,且等浓度时碱性C>D>E,B可做生氧剂,则B中含有的化学键类型为__________________;
A转化成C的离子方程式为: ________________________________,
D转化成E的离子方程式为_______________________________________。
(3)若常温下B、C、D均为气体,且B气体能使湿润的红色石蕊试纸变蓝
①在工业上生产B气体时为了加快反应速率应选择的条件是______________,其中能提高反应物的转化率的条件是___________。
②C、D是汽车尾气中的有害成分,用NaOH溶液吸收可消除污染,反应的化学方程式为______________________________ ____。
____。
参考答案:(1)①③(2)离子键、非极性共价键,2Na+2H2O=2Na++2OH-+H2↑,CO32-+CO2 +H2O=2HCO3?
+H2O=2HCO3?
(3)①高温、高压、催化剂;高压 ②NO+
②NO+ NO2+2NaOH=2NaNO2+H2O(每空2分,共14分)
NO2+2NaOH=2NaNO2+H2O(每空2分,共14分)
本题解析:略
本题难度:简单
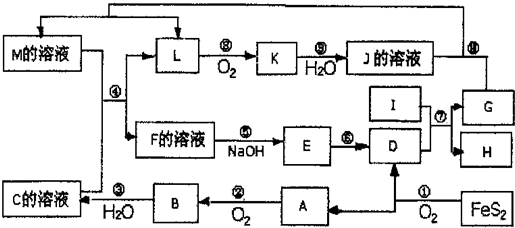
3、填空题 下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法?。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:?。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是?。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为?。

参考答案:(1)四?Ⅷ(2分)(2)2:1(2分)
(3)取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色(其他合理答案)?(2分)(4)2Fe3++2I-=2Fe2++I2(2分)
(5)Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O(2分)(6)① 防止Mg、Al被空气氧化(2分)
2K2FeO4+3KNO2+2H2O(2分)(6)① 防止Mg、Al被空气氧化(2分)
②2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O(2分)
本题解析:FeS2氧化得到的A可以继续被氧化,则A为SO2,B为SO3,C为B的水化物,C为H2SO4,D为Fe2O3,I为地壳中含量最高的金属,应为Al,反应⑦为铝单质与金属氧化物所发生的置换反应,即铝热反应.K是一种红棕色气体,为NO2,则J为HNO3,L被氧化成为NO2,故L可能为氨或NO2,由于C溶液,即硫酸溶液能与某M溶液反应得到L,故L不可能是碱性的气体氨气,故L为NO,G能与硝酸反应并能产生NO,故G为Fe,H为Al2O3。过量G与J溶液反应生成M,因此M应该是硝酸亚铁。由于D为Fe2O3,而由框图中可知E为氢氧化物,E经由一步转变为D,故E为Fe(OH)3,而E直接由F加入碱而得到,故F为三价铁离子,其阴离子可能为硫酸根与硝酸根的混合物,或者是仅有硫酸根离子,由于题目所给物质名称仅为F,故可知F为纯净物硫酸铁,则
(1)在周期表中,组成单质G的元素是铁位于第四周期第Ⅷ族。
(2)反应⑦是铝与氧化铁的铝热反应,方程式为2Al+Fe2O3 2Fe+Al2O3,其中还原剂是铝,氧化剂是氧化铁,因此还原剂与氧化剂的物质的量之比为2:1。
2Fe+Al2O3,其中还原剂是铝,氧化剂是氧化铁,因此还原剂与氧化剂的物质的量之比为2:1。
(3)亚铁离子具有还原性,因此M溶液中亚铁离子的检验方法为取出部分溶液于试管中加入KSCN,溶液没有变化,再加入少量氯水,溶液变为红色。
(4)铁离子具有氧化性,能把碘离子氧化生成单质碘,则反应的离子方程式为2Fe3++2I-=2Fe2++I2。
(5)根据电子得失守恒以及原子守恒可知,该反应的化学方程式是Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
2K2FeO4+3KNO2+2H2O。
(6)①镁和铝都是活泼的金属,极易被氧化,因此熔炼制备该合金时通入氩气的目的是防止Mg、Al被空气氧化。
②原电池中活泼的金属作负极失去电子被氧化,因此该原电池中铝是负极失去电子,AgO得到电子,由于电解质是氢氧化钠所以总的化学方程式为2Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。
本题难度:困难
4、选择题 物质A~E的转化关系如图所示:
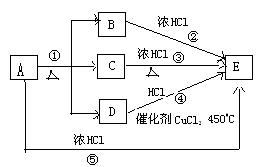
已知气体单质D能使带火星的木条复燃,反应①是实验室制单质D的常用方法之一,反应②是实验室制黄绿色气体E的重要反应,(部分生成物未列出)。
依据上述信息,回答下列问题:
(1)A的化学式?
(2) 从氯元素化合价的变化看,以上写出反应②③④⑤四种方法的共同点是?
(3)写出反应④的化学方程式?
(4)利用反应③④⑤的变化,不写化学方程式比较A、C、D的氧化性由大到小的顺序?
(5)写出反应②的离子方程式?,氧化剂与还原剂的物质的量之比?
参考答案:(1)KMnO4
(2)氯元素的化合价由-1价升高到0价
(3)4HCl+O2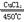 2Cl2+2H2O
2Cl2+2H2O
(4)KMnO4>MnO2>O2
(5) MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;? 1:2
Mn2++Cl2↑+2H2O;? 1:2
本题解析:本题以氧气、氯气的实验室制备为素材,注意两者制备方法均为氧化还原反应,二者都以高锰酸钾为反应物,这是解题的突破口。很显然,黄绿色气体单质为氯气,单质D为氧气,A为高锰酸钾。框图的终点物质为氯气,都是和盐酸反应,所以,②③④⑤四个反应的共同点为用不同的氧化剂均将浓盐酸氧化为氯气,氯元素的化合价由-1价升高到0价。根据③④⑤三个反应中反应条件的差异(常温反应、加热、加热催化剂),得出A、C、D的氧化性由大到小的顺序为KMnO4>MnO2>O2。
本题难度:一般
5、推断题 下图表示某些物质之间的转化关系,每个字母代表一种物质,部分产物已略去。A是一种酸式盐,也是一种常用的化学肥料,B是能使湿润的红色石蕊试纸变蓝色的无色气体,D是无色无味的气体。回答下列问题。
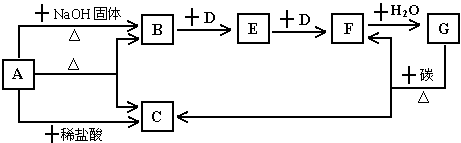
(1)物质A的名称是:___________________
(2)写出物质B的一种主要用途:___________________
(3)写出工业上制取气体B的化学方程式:___________________
(4)实验室收集E、F的方法:E_________ D_________
参考答案:(1)碳酸氢铵
(2)工业制硝酸(或制氮肥,制氨水等)
(3)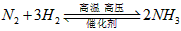
(4)排水法;向上排空气法
本题解析:
本题难度:一般