微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将铁粉和硫粉混合后加热,待反应一发生即停止加热,反应仍可持续进行,直至反应完全生成新物质硫化亚铁。这现象说明了
A.该反应是吸热反应
B.该反应是放热反应
C.铁粉和硫粉在常温下可以发生反应
D.硫化亚铁的总能量高于铁粉和硫粉的总能量
参考答案:B
本题解析:反应一发生即停止加热,反应仍可持续进行,这说明该反应是放热反应,即反应物的总能量高于生成物的总能量。所以正确的答案选B。
本题难度:简单
2、选择题 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。下列关系中正确的是
A.2E1=E2
B.2E1>E2
C.2E1<E2
D.E1=E2
参考答案:B
本题解析:形成化学键,放出能量,氢原子生成氢分子是放热的,所以选项B正确,答案选B。
本题难度:一般
3、填空题 (13分)①判断下列描述的正误(正确的打“√”,错误的打“×”)。
(1)1 mol酸与1 mol碱完全反应放出的热量是中和热。( )
(2)物质具有的能量越高,物质的稳定性越强。( )
(3)化学反应的过程,既遵循质量守恒定律,也遵循能量守恒定律。(?)
(4)在确定的化学反应体系中,反应物的总能量与生成物的总能量一定不同。( )
(5)需要加热才能进行的反应一定是吸热反应。( )
②已知下列反应的反应热为:
(1)CH3COOH(l)+2O2(g)===?2CO2(g)+2H2O(l)? △H1=" -" 870.3 kJ? mol-1
(2)C(s)+O2(g) ===?CO2(g)? △H= -393.5kJ? mol-1?
(3)H2(g)+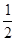 O2(g) ===?H2O(l) △H=" -" 285.8kJ? mol-1?
O2(g) ===?H2O(l) △H=" -" 285.8kJ? mol-1?
试计算下列反应的反应热:2C(s)+2H2(g)+O2(g) ===CH3COOH(l) △H= _____________。
参考答案:(13分)① ×、×、√、√、×? ②-488.3kJ? mol-1
本题解析:①考查反应热的有关判断。
中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量,所以(1)是不正确的;物质具有的能量越低,物质的稳定性越强,因此(2)不正确;质量守恒定律和能量守恒定律,是化学反应必须遵循的两个基本定律,(3)正确;任何化学反应都伴随着能量的变化,所以在确定的化学反应体系中,反应物的总能量与生成物的总能量一定不同,(4)正确;反应是放热反应还是吸热反应,与反应条件是无关的,只与反应物和生成物总能量的相对大小有关系,(5)不正确。
②考查反应热的有关计算。
根据盖斯定律可知,(3)×2+(2)×2-(1)即得到反应2C(s)+2H2(g)+O2(g) ===CH3COOH(l) ,所以该反应的反应热△H=-285.8kJ? mol-1×2-393.5kJ? mol-1×2+870.3 kJ? mol-1=-488.3kJ? mol-1。
本题难度:一般
4、选择题 下列热化学方程式正确的是(△H的绝对值均正确)(?)
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ·mol-1(燃烧热)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=+57.3kJ·mol-1(中和热)
C.S(s)+O2(g)=SO2(g)ΔH=-269.8kJ·mol-1(反应热)
D.2NO2=2NO+O2ΔH=+116.2kJ·mol-1(反应热)
参考答案:C
本题解析:A、燃烧热是指在一定压强下,1mol的可燃物完全燃烧生成稳定的氧化的时候所放出的热量,那么对于水而言,液态才是稳定状态,错误;B、中和热都是放出的热量,而不是吸收的,错误;C、正确;D、反应物与生成物都没有标明状态,错误。
本题难度:一般
5、填空题 (8分)如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
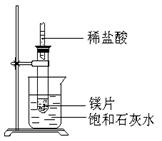
(1)实验中观察到的现象是?
?。
(2)产生该现象的原因?
(3)写出有关反应的离子反应方程式?
(4)由此推知,MgCl2溶液和H2的总能量??填(“大于”“小于”或“等于”)镁片和盐酸的总能量
参考答案:(1)向镁片表面产生气泡,逐渐减少;烧杯中有固体物质析出.
(2)镁跟盐酸反应产生氢气,并放出热量;Ca(OH)2的溶解度随温度的升高而变小.
(3)Mg+2H+═Mg2++H2↑ 2分?(4)小于
本题解析:镁是活泼的金属,和盐酸反应生成氯化镁和氢气。由于反应物的总能量高于生成物的总能量,因此是放热反应。由于反应放热,使溶液的温度升高。又因为Ca(OH)2的溶解度随温度的升高而变小,所以会析出氢氧化钙晶体。
本题难度:一般