微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
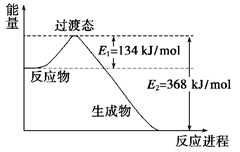
1、填空题 (10分) (1)下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2
和CO反应的热化学方程式:_____________________________________。
(2)我国实施“嫦娥探月”行动的长征火箭中使用偏二甲肼[(CH3)2N—NH2]作为燃料,其与过氧化氢发生反应放出大量热量C2H8N2(l)+8H2O2(l)===N2(g)+2CO2(g)+12H2O(g) ΔH=-2 500 kJ/mol。如果1 mol偏二甲肼与过氧化氢发生上述反应生成液态水,则反应中放出的热量Q______2 500 kJ(填“<”、“>”或“=”)。
(3)恒温恒容下,2 mol H2与2 mol N2反应达到平衡时,N2为1.8 mol,H2的转化率为________;若该反应在恒温恒压条件下进行(其他条件相同),反应达平衡时,H2的转化率比上述条件下H2的转化率________(填“大”、“小”或“相等”)。
(4)由甲烷、氧气和KOH溶液组成的新型燃料电池中,正极上发生反应的电极反应式为________________。
参考答案:(1)NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol (3分)
(2)>
(3)30% ?大
(4)O2+2H2O+4e-===4OH-
本题解析:(1)根据图像可知,反应物的总能量高于生成物的总能量,所以反应是放热反应,反应热是134kJ/mo-l368kJ/mol=-234kJ/mol,所以热化学方程式是NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234 kJ/mol。
(2)由于气态水的能量高于液态水的能量,所以偏二甲肼燃烧生成液态水放出的能量多,即Q大于2500kJ。
(3)N2为1.8 mol,则消耗氮气是0.2mol,所以消耗氢气是0.6mol,因此氢气的转化率是0.6÷2=0.3,即转化率是30%。由于合成氨的反应是体积减小的可逆反应,所以压强也是减小的,因此在恒温恒压条件下进行时,有利于平衡向正反应方向进行,即氢气的转化率增大。
(4)原电池中负极失去电子,正极得到电子,因此氧气在正极通入。由于电解质时氢氧化钾,所以正极反应式是O2+2H2O+4e-===4OH-。
本题难度:一般
2、选择题 已知一定温度下,N2和H2反应生成2mol NH3时放出的热量为92.0 kJ,此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(? )[忽略能量损失]
A.一定大于92.0 kJ
B.一定等于92.0 kJ
C.一定小于92.0 kJ
D.不能确定
参考答案:C
本题解析:略
本题难度:简单
3、选择题 参照反应Br+ ?
? HBr+H的能量对反应历程的示意图,下列叙述中正确的是
HBr+H的能量对反应历程的示意图,下列叙述中正确的是
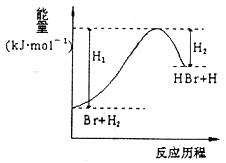
A.正反应为放热反应
B.HBr能量一定高于H2的能量
C.增大反应容器的压强对反应速率没有影响
D.该反应正反应为储能过程
参考答案:D
本题解析:略
本题难度:简单
4、选择题 参照反应Br+H2―→HBr+H的能量对反应历程的示意图(图甲)进行判断。下列叙述中不正确的是
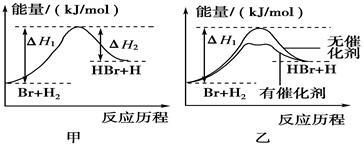
A.正反应吸热
B.加入催化剂,该化学反应的反应热不变
C.加入催化剂后,该反应的能量对反应历程的示意图可用图乙表示
D.加入催化剂可增大正反应速率,降低逆反应速率
参考答案:D
本题解析:整个反应的ΔH=ΔH2-ΔH1,ΔH>0,为吸热反应。A选项正确。B选项加入催化剂会影响活化能,但不影响反应热,所以反应热不变。B选项正确。乙图可以正确描述加入催化剂的影响,C选项正确。D选项中,加入催化剂会同时改变正逆反应,既增大正反应速率,又增大逆反应速率。D选项错误。
点评:本题综合了很多化学反应的知识,需清楚地了解催化剂的作用。
本题难度:一般
5、选择题 下列有关能量转化的认识不正确的是( )
A.植物光合作用时,太阳能转化为化学能
B.电解水生成氢气和氧气时,电能转化为化学能
C.白炽灯工作时,电能全部转化为光能
D.垃圾处理厂可将生活垃圾中的生物质能转化为热能、电能等
参考答案:A、植物的光合作用是把太阳能转化为化学能,吸入二氧化碳呼出氧气,故A正确;
B、电解水生成氢气和氧气时,电能转化为化学能,故B正确;
C、白炽灯工作时,电能转化为光能、热能,故C错误;
D、垃圾处理厂利用垃圾发电可将生活垃圾中的生物质能转化为热能、电能等,故D正确;
故选:C;
本题解析:
本题难度:简单