微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 甲醇(CH3OH)作为新型汽车动力燃料,以下是甲醇在工业上的制备和生活中的应用。
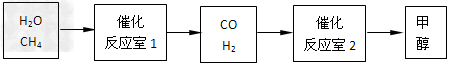
请填空: ?
(1)在压强为0.1MPa条件下,反应室2(容积为VL)中a?mol?CO与2a?mol?H2在催化剂作用下反应生成甲醇:CO?(g)?+2H2(g)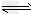 CH3OH?(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH?(g),CO的平衡转化率与温度、压强的关系如图所示,则:
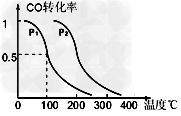
①一定条件下的密闭容器中,该反应到达平衡,要提高CO的转化率可以采取的措施是_______?(填字母代号)
A.高温高压?B.加入催化剂?C.增加CO的浓度?D.增大氢气的浓度?E分离出甲醇
②在压强P1、100℃时,CH3OH(g) CO(g)?+?2H2(g)反应的平衡常数为________(用含a、V的代数式表示)
CO(g)?+?2H2(g)反应的平衡常数为________(用含a、V的代数式表示)
③将一定量的NO2与SO2置于绝热恒容密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。
SO3(g)+NO(g)上述反应,正反应速率随时间变化的趋势如图所示。由图可知下列说法正确的是__________(填字母)。

A.反应在c点达到平衡状态
B.反应物浓度:a点小于b点
C.反应物的总能量高于生成物的总能量
D.△t1=△t2时,SO2的消耗量:a~b段大于b~c段
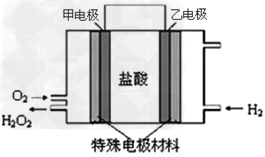
(2)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以H2和O2为原料制取过氧化氢的新工艺。原理如图所示:请写出甲电极的电极反应式:________________________。
(3)若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52?kJ的能量,则等质量的甲醇燃料电池利理论上可提供________mol电子的电量。(已知甲醇的燃烧热为725.76?kJ/mol)
(4)已知在常温常压下:
①2CH3OH?(l)+3O2(g)?==?2CO2(g)+4H2O?(g) ΔH1=-1275.6?kJ/mol
②2CO?(g)+O2(g)?==?2CO2(g)?ΔH2=-566.0?kJ/mol
③H2O?(g)?=?H2O?(l) ΔH3=-44.0?kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________。
2、选择题 在一密闭容器中,反应aA(g)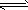 bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
[? ]
A.平衡向逆反应方向移动了
B.物质A的转化率减少了
C.物质B的质量分数增加了
D.a>b
3、选择题 在容积为2L的容器内发生反应: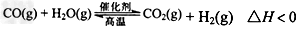 ,起始时充入1mol?CO和0.8mol?H2O,经过2min后,反应达到平衡状态,此时CO2的浓度为0.2mol/L,下列说法正确的是
,起始时充入1mol?CO和0.8mol?H2O,经过2min后,反应达到平衡状态,此时CO2的浓度为0.2mol/L,下列说法正确的是
[? ]
A.该反应的平衡常数为: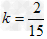 ?
?
B.CO和H2O的转化率相同
C.2min内,用H2表示的反应速率为:v(H2)=0.lmol/(L·min)
D.升高温度时,V正减小,v逆增大
4、选择题 汽车尾气净化中的一个反应如下:NO(g)+CO(g)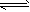 1/2N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) △H=-373.4kJ·mol-1。 在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
[? ]
A.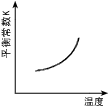
B.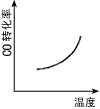
C.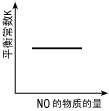
D.
5、填空题 在经济飞速发展的今天,节能和地球环境成了人们关注的主题。每年的6月5日是“世界环境日”,2010年世界环境日主题是“促进低碳经济”。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”。下列化学反应不符合“绿色化学”思想的是________。
A.制备环氧乙烷:2CH2=CH2+O2→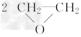 ?
?
B.制备二氧化硫:Cu+2H2SO4→CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2 2CH3OH
2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(2)冶金废水中含有[Au(CN)2],其电离出的CN-有毒,当与H+结合生成HCN时,其毒性更强。工业上处理这种废水是在碱性条件下,用NaClO将CN-氧化为CO32-和一种无毒气体,该反应的离子方程式为________________________,在酸性条件下,ClO-也能将CN-氧化,但实际处理时却不在酸性条件下进行的主要原因是______________________。
(3)二甲醚是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。相关的反应如下:
①2H2(g)+CO(g)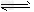 CH3OH(g) ΔH=-90.8?kJ/mol
CH3OH(g) ΔH=-90.8?kJ/mol
②2CH3OH(g)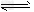 CH3OCH3(g)+H2O(g) ΔH=-23.5?kJ/mol
CH3OCH3(g)+H2O(g) ΔH=-23.5?kJ/mol
③CO(g)+H2O(g)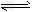 CO2(g)+H2(g) ΔH=-41.3?kJ/mol
CO2(g)+H2(g) ΔH=-41.3?kJ/mol
总反应:3H2(g)+3CO(g)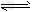 CH3OCH3(g)+CO2(g)的ΔH=________。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
CH3OCH3(g)+CO2(g)的ΔH=________。一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,可以采取的措施是________(填字母代号)。
a.高温高压? ? b.加入催化剂? ? c.减少CO2的浓度
d.增加CO的浓度? ? e.分离出二甲醚