|
高中化学必备知识点《物质组成与性质实验方案的设计》考点强化练习(2017年押题版)(十)
2017-08-08 05:42:38
来源:91考试网
作者:www.91exam.org 【 大 中 小】
回答下列各问题:(1)正确操作步骤的顺序是(用字母填写)?→?→?→ D →?。
(2)滴定管的读数应注意?。
(3)E中在锥形瓶下垫一张白纸的作用是?。(4)D步骤中液面应调节到?,尖嘴部分应?。
(5)滴定终点时锥形瓶内溶液的pH约为?,终点时颜色变化是?。
(6)若酸式滴定管不用标准硫酸润洗,在其它操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(指偏高、低或不变)?(7)该烧碱样品纯度的计算式为?。
参考答案:

本题解析:略
本题难度:简单
2、实验题 “卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定
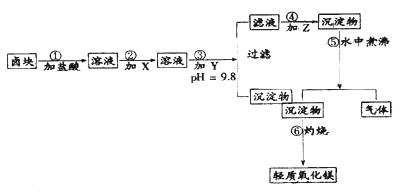
轻质氧化镁生产工艺流程图
表1?生成氢氧化物沉淀的PH值
物质
| 开始沉淀
| 沉淀完全
| Fe(OH)3
Fe(OH)2
Mn(OH)2
Mg(OH)2
| 2.7
7.6
8.3
9.6
| 3.7
9.6
9.8
11.1
|
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2?化学试剂价值表
试剂
| 价格(元/t)
| 漂液(含NaClO25.2%)
H2O2(30%)
NaOH(固98%)
Na2CO3(固99.5%)
卤块(MgCl2,30%)
| 450
2400
2100
600
310
|
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是??,其作用是??。
(2)步骤③加入的试剂Y应是??;之所以要控制pH=9.8,其目的是??。
(3)在步骤⑤时发生的化学反应方程式是:??
参考答案:(l)漂液,使Fe2+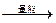 Fe3+ Fe3+
(2)NaOH使杂质离子(Fe3+、Mn2+)沉淀完全又尽量减少Mg2+损失
(3)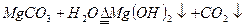
本题解析:在题目第一段阅读中要明确试题要求:(1)由卤块(含杂质的MgCl2)制得“轻质氧化镁”(不含杂质Fe2+、Fe3+、Mn2+离子)(2)成本较低。在阅读观察工艺流程图要明确:(3)杂质离子在步骤③加入Y(NaOH)强调PH=9.8除(成为 Fe(OH)3、Mn(OH)2沉淀)(4)步骤④、⑤、⑥是由MgCl2(含Na+)到轻质氧化镁的转化、制备过程。(3)通过逆向思维:MgO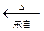 Mg(OH)2 Mg(OH)2 MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。 MgCO3。因此步骤③所得滤液中应加Z是Na2CO3(步骤④)所得沉淀物为MgCO3,经过步骤⑤在水中煮沸,MgCO3水解生成 Mg(OH)2,并放出CO2气体。
在阅读附表1时需结合试题分析(5)在步骤②需加氧化剂使Fe2+转化为Fe3+以便沉淀完全容易除去。(6)步骤③控制PH=9.8是为了使Mn(OH)2沉淀完全,虽然Mg(OH)2已开始沉淀会影响产率,但保证了产品纯度,且原料卤块价格比较低廉。(7)在阅读附表2时可以从成本较低的角度考虑步骤②
本题结合工业生产实际考查无机化合物(轻质氧化镁)的转化生成、分离、提纯问题。涉及了金属元素(Mg、Fe、Mn)及其化合物相互转化的知识和信息加工、迁移能力,逻辑推理和逆向思维能力。
本题难度:一般
3、实验题 检验溶液中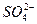 为什么要将原溶液用稀硝酸酸化,用稀盐酸酸化可以吗?哪一个更好? 为什么要将原溶液用稀硝酸酸化,用稀盐酸酸化可以吗?哪一个更好?
参考答案:用稀盐酸酸化也可以,用稀盐酸更好。
本题解析:检验硫酸根,利用其钡盐既不溶于水又不溶于酸的白色沉淀来检验,但氯化银也是既不溶于水也不溶于酸的白色沉淀,且如果用稀硝酸酸化时,稀硝酸可将溶液中可能存在的亚硫酸根氧化成硫酸根从而干扰实验的判断,所以不仅是可用盐酸,而且从上文中可以看出,用稀盐酸既能排除银盐的干扰,又能排除亚硫酸盐的干扰,结果更可靠。
本题难度:简单
4、实验题 兴趣小组通过实验探究溶解铜的方法和本质。
(1)在热水浴中进行3个实验,部分实验报告如下表所示。

①实验I、Ⅱ的目的是____________。
②实验Ⅲ中反应的本质是(用离子方程式表示)____________________。
(2)利用电化学原理实现铜溶于稀硫酸并生成氢气。
①Cu作_______极。②总反应的离子方程式是________________。
参考答案:(1)①证明Cu不与H+、NO3-单独反应;②3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(2)①阳;②Cu+2H+ Cu2++H2↑ Cu2++H2↑
本题解析:
本题难度:一般
5、简答题 (2014届河南省商丘市高三第二次模拟考试理综化学试卷)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理, 回答下列问题:
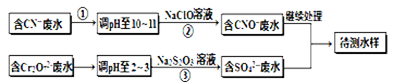
(1)上述处理废水流程中主要使用的方法是?。
(2)②中反应后无气体放出,该反应的离子方程式为?。
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应离子方程式为?。
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液, 蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因?。
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是?。 (铁氧磁体,罗马数字表示元素价态)的沉淀。处理1mol Cr2O72-,需加入a mol FeSO4?7H2O,下列结论正确的是?。
A.x ="0.5" ,a =8
B.x ="0.5" ,a = 10
C.x =" 1.5" ,a =8
D.x =" 1.5" ,a = 10
参考答案:(15分)(1)氧化还原法(3分)?(2)CN-+ClO-=CNO-+Cl-(3分)
(3)3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O(3分)
(4)Cu2++2OH-=Cu(OH)2↓? Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)
因为:KSP(CuS)<KSP[Cu(OH)2]? (3分)?(5)D(3分)
本题解析:
(1)处理废水流程中CN-→CNO-;Cr2O72-→Cr3+。因此使用的方法是氧化还原法。
(2)②中反应NaClO将CN-氧化,无气体放出,产物为CNO-,即:CN-+ClO-===CNO-+Cl-。
(3)步骤③中,反应是1mol Cr2O72-时转移电子6mol,即Cr2O72-→Cr3+,3S2O32-+4Cr2O72-+26H+="==" 6SO42-+8Cr3++13H2O。
(4)取少量待测水样于试管中,加入NaOH溶液,生成蓝色沉淀Cu(OH)2,再加Na2S溶液,Cu(OH)2转化成黑色沉淀CuS(s),说明KSP(CuS)<KSP[Cu(OH)2]。
(5)设最终生成了y mol混合物。寻找关系:
Cr元素量不变,则有:(2-x)y=2
Fe元素量不变,则有:(1+x)y=a
Fe失去的电子量=Cr得到的电子量,则有:xy=2×(6-3)=6
得:X=1.5,y=4,a=10
本题难度:一般
|