微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是?(?)
A.1 mol氧的质量是16g
B.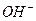 的摩尔质量是17g
的摩尔质量是17g
C.1 molH2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
2、计算题 将一定量的CO2气体通入500 mL某NaOH溶液中,充分反应后。将溶液在低温下蒸发。得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50 mL相同浓度的盐酸反应.得到气体的体积(标准状况)如下表所示。
组别
| ①
| ②
| ③
|
盐酸的体积mL
| 50
| 50
| 50
|
固体A的质量g
| 3.80
| 6.20
| 7.20
|
气体体积mL
| 896
| 1344
| 1344
|
?
小题1:上表中第?组数据表明加入的50mL盐酸有剩余,其理由是?
小题2: 通过计算讨论判断固体A是什么物质?其成分的质量分数是多少?
3、选择题 有Na2S、Na2SO3和Na2SO4的混合物,经测定此混合物中硫的质量分数为32%.则此混合物中氧的质量分数为( )
A.36.8%
B.37.6%
C.22.0%
D.无法计算
4、选择题 下列溶液中的n (Cl-)与100ml 1 mol·L-1AlCl3溶液中的n(Cl-)相等的是
A.150ml 1 mol·L-1氯化钠溶液
B.75ml 2 mol·L-1氯化镁溶液
C.50ml 3mol·L-1氯化钾溶液
D.50ml 1 mol·L-1氯化铁溶液
5、计算题 硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
①? Na2SO4+ 4C→ Na2S+ 4CO↑?②? Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。