微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法中,正确的是?(?)
A.1 mol氧的质量是16g
B.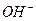 的摩尔质量是17g
的摩尔质量是17g
C.1 molH2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
参考答案:D
本题解析:略
本题难度:简单
2、计算题 将一定量的CO2气体通入500 mL某NaOH溶液中,充分反应后。将溶液在低温下蒸发。得到不含结晶水的白色固体A。取三份质量不同的该白色固体A分别与50 mL相同浓度的盐酸反应.得到气体的体积(标准状况)如下表所示。
组别
| ①
| ②
| ③
|
盐酸的体积mL
| 50
| 50
| 50
|
固体A的质量g
| 3.80
| 6.20
| 7.20
|
气体体积mL
| 896
| 1344
| 1344
|
?
小题1:上表中第?组数据表明加入的50mL盐酸有剩余,其理由是?
小题2: 通过计算讨论判断固体A是什么物质?其成分的质量分数是多少?
参考答案:
小题1:第一组有剩余,盐酸的量相同但产生的气体比2 ,3组少,说明盐酸过量。
小题2:A是Na2CO3和NaHCO3的混合物?
Na2CO3的质量分数:55.8%,NaHCO3的质量分数:44.2%
本题解析:
小题1:实验②比实验①中固体质量增加,同时生成的气体也增加,这说明在实验①盐酸是过量的。实验③在实验②的基础上继续增加固体的质量,但气体的体积不再发生变化,这说明在实验③盐酸是不足的,固体过量。
小题2:因为CO2和氢氧化钠反应可以生成两种盐碳酸钠和碳酸氢钠,所以如果固体中只有碳酸钠,则生成的二氧化碳是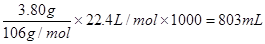 <896ml,这说明A是Na2CO3和NaHCO3的混合物,然后根据实验①列式进行计算即可。
<896ml,这说明A是Na2CO3和NaHCO3的混合物,然后根据实验①列式进行计算即可。
解:根据第一组数据,若只有Na2CO3,则气体产生的量为
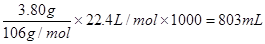 <896ml
<896ml
这就说明A是Na2CO3和NaHCO3的混合物。
设原有的碳酸钠物质的量为X,碳酸氢钠物质的量为Y,依题意得
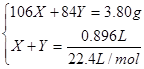 ?解之得x=0.02mol? y=0.02mol
?解之得x=0.02mol? y=0.02mol
所以 Na2CO3的质量分数: 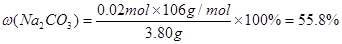 ,则NaHCO3的质量分数为44.2%。
,则NaHCO3的质量分数为44.2%。
本题难度:一般
3、选择题 有Na2S、Na2SO3和Na2SO4的混合物,经测定此混合物中硫的质量分数为32%.则此混合物中氧的质量分数为( )
A.36.8%
B.37.6%
C.22.0%
D.无法计算
参考答案:Na2S、Na2SO3和Na2SO4中,Na与S原子个数比为2:1,二者物质的量之比为2:1,所以Na与S的质量比为:(23×2):32=23:16,
经测定此混合物中硫的质量分数为32%,所以钠的质量分数为:32%×2316=46%,
混合物中氧元素的质量分数为:1-ω(Na)-ω(S)=1-32%-46%=22%,
故选C.
本题解析:
本题难度:一般
4、选择题 下列溶液中的n (Cl-)与100ml 1 mol·L-1AlCl3溶液中的n(Cl-)相等的是
A.150ml 1 mol·L-1氯化钠溶液
B.75ml 2 mol·L-1氯化镁溶液
C.50ml 3mol·L-1氯化钾溶液
D.50ml 1 mol·L-1氯化铁溶液
参考答案:B
本题解析:略
本题难度:简单
5、计算题 硫化钠是由无水硫酸钠与炭粉在高温下反应制得。反应的化学方程式如下:
①? Na2SO4+ 4C→ Na2S+ 4CO↑?②? Na2SO4+ 4CO→ Na2S+ 4CO2↑
(1)要制取Na2S 15.6 g,需原料芒硝(Na2SO4·10H2O)_____________mol。
(2)制得的Na2S固体中含少量Na2SO4、碳粉等杂质。称取该固体0.200 g,加适量水溶解后加入25.0 mL 0.100 mol/L的I2标准液,待反应完全后用0.100 mol/L Na2S2O3溶液滴定,消耗Na2S2O3溶液16.0 mL(已知:滴定时 Na2S2O3转化为Na2S4O6),则该Na2S的纯度为__________。
(3)① 若在反应过程中,产生CO和CO2混合气体的体积为44.8L(标准状况),生成Na2S的物质的量(n mol)的范围是__________< n < ___________;
② 若在上述过程中生成Na2S的质量为62.4 g,则混合气体中CO和CO2的体积比是多少?
(4)硫化钠晶体(Na2S·9H2O)放置在空气中,会缓慢氧化成Na2SO3·7H2O和Na2SO4·10H2O。现称取在空气中已部分氧化的硫化钠晶体25.76 g溶于水,加入足量用盐酸酸化的BaCl2溶液,过滤得沉淀5.62 g,放出H2S气体1.12 L(标准状况),求原硫化钠晶体的质量。
参考答案:(1)0.2(2分)
(2)66.3%(2分)
(3)①0.5? 1.0(2分)?②? 2:3(3分)
(4)24g(5分,列式3分,计算过程及结果2分)
本题解析:(1)要制取Na2S 15.6 g,需原料芒硝。根据硫原子守恒可知, ,解得(Na2SO4·10H2O)0.2mol。
,解得(Na2SO4·10H2O)0.2mol。
(2)根据两步转化关系通过计算求得Na2S的纯度为 66.3%。
(3)①由反应①和②可得反应③:Na2SO4+ 2C Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:0.5 mol ~ 1 mol。②若在上述过程中生成Na2S的质量为62.4 g,即为0.8mol。设混合气体中CO和CO2的物质的量分别是x,a。则有
Na2S + 2CO2↑根据反应①和反应③,由极值法得:消耗的碳单质的物质的量范围n的范围是:0.5 mol ~ 1 mol。②若在上述过程中生成Na2S的质量为62.4 g,即为0.8mol。设混合气体中CO和CO2的物质的量分别是x,a。则有
①:? Na2SO4+? 4C ? Na2S +? 4CO
? Na2S +? 4CO
x mol? x/4 mol? x mol
根据反应③:? Na2SO4+? 2C  ?Na2S? +? 2CO2
?Na2S? +? 2CO2
a mol? a/2 mol? a mol
根据题意得:? a mol + x mol ="2" mol
a/2mol + x/4? mol =" 0.8" mol,解得:a=1.2,x-0.8,则CO和CO2的体积比为3:2。
(4)5.62 g沉淀是硫酸钡和硫, 1.12 LH2S气体物质的量是0.05mol。设硫的物质的量为amol,硫酸钠的物质的量为bmol,则根据下列两个方程式可建立关系式:
2Na2S+ Na2SO3+6 HCl="6NaCl+" 3S↓+3H2O
2a/3? a/3? a
Na2S+ 2HCl= NaCl+H2S
0.05mol? 0.05mol?
233b+32a=5.62;再根据质量守恒:25.76 = a/3(126*2)+322b+(0.05+2a/3)*78,再根据硫原子守恒,求出原硫化钠晶体的质量24g。
本题难度:一般