微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (1)写出一个能证明还原性Fe比Cu强的离子方程式:_______________________;
(2)根据上述反应设计一个原电池,画出简易装置图(标出电极名称、电极材料、电解质溶液 )
__________________________;
(3)若该电池中两电极的总质量为60g,工作一段时间后,取出两电极洗净干燥后称量,总质量为
62g,则反应过程中转移电子的数目为_______________________。
参考答案:(1)Fe+Cu2+==Fe2++Cu
(2)
(3)3.01×1023或0.5NA
本题解析:
本题难度:一般
2、选择题 称取三份5.6g铁片分别加入装有下列物质的三支试管中:
①50 mL4 mol·L-1 H2SO4;
②50 mL4 mol·L-1 H2SO4+2 g Cu 片;
③50 mL 4 mol·L-1 H2SO4+2 g Cu粉。
则下列关于生成氢气的速率及生成氢气的总量的比较中正确的是
[?]
A.生成氢气的速率:③>②>①,生成氢气的总量:①=②=③?
B.生成氢气的速率:②>③>①,生成氢气的总量:①=②=③?
C.生成氢气的速率:③>②>①,生成氢气的总量:①>②>③?
D.生成氢气的速率和氢气的总量都相等
参考答案:A
本题解析:
本题难度:一般
3、填空题 多晶硅是太阳能光伏产业的重要原料。
(1)由石英砂可制取粗硅,其相关反应的热化学方程式如下:
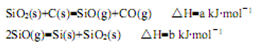
①反应SiO2(s)+2C(s)=Si(s)+2CO(g)的△H=?kJ·mol-1(用含a、b的代数式表示)。
②SiO是反应过程中的中间产物。隔绝空气时,SiO与NaOH溶液反应(产物之一是硅酸钠)的化学方程式是?。
(2)粗硅提纯常见方法之一是先将粗硅与HCl制得SiHCl3,经提纯后再用H2还原:SiHCl3(g)+H2(g) Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;
Si(s)+3HCl(g)不同温度及不同n(H2)/n(SiHCl3)时,反应物X的平衡转化率关系如图;

①X是?(填“H2”、“SiHCl3”)。
②上述反应的平衡常数K(1150℃)?K(950℃)(选填“>”、“<”、“=”)
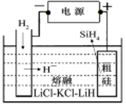
(3)SiH4(硅烷)法生产高纯多晶硅是非常优异的方法。
①用粗硅作原料,熔盐电解法制取硅烷原理如图10,电解时阳极的电极反应式为? 。
②硅基太阳电池需用N、Si两种元素组成的化合物Y作钝化材料,它可由SiH4与NH3混合气体进行气相沉积得到,已知Y中Si的质量分数为60%,Y的化学式为?。
参考答案:
(1)①2a+b?②? SiO+2NaOH=Na2SiO3+H2↑
(2)①SiHCl3?②>
(3)Si - 4e-?+ 4H- = SiH4↑? Si3N4
本题解析:(1)方程式中上式乘2加下式即得;(2)根据氧化还原反应化合价升降确定还原产物为H2, SiO+2NaOH=Na2SiO3+H2↑;(3)随着横坐标数值增大,氢气的含量增大,X转化率增大,所以该物质是SiHCl3;相同比值时,温度越高,SiHCl3转化率越大,故正反应为吸热反应,温度越高K值越大;(3)电解时粗硅溶解结合介质中的H-,故为Si-4e-+ 4H- = SiH4↑;根据质量关系计算物质的量关系确定化学式。
本题难度:困难
4、选择题 如下图所示,把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。下列叙述正确的是
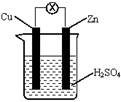
A.Zn是负极,发生还原反应
B.该装置将电能转变为化学能
C.一段时间后,电解质溶液的酸碱性保持不变
D.电流从铜片流向锌片
参考答案:D
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,所以锌是负极,失去电子。铜是正极,溶液中的氢离子得到电子,所以选项D正确,其余都是错误的,答案选D。
本题难度:一般
5、选择题 在用Zn片、Cu片和稀硫酸组成的电池装置中,经过一段时间工作后,下列说法中正确的是( )
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片经导线流向铜片
C.溶液中的阳离子向正极移动,阴离子向负极移动
D.电解液的pH值逐渐减小
参考答案:A、锌片是负极,铜片上有气泡产生,故A错误;
B、电流方向是从Cu片经导线流向Zn片,故B错误;
C、溶液中的阳离子向正极移动,阴离子向负极移动,故C正确;
D、因氢离子参加反应生成氢气,氢离子减少,则电解液的pH增大,故D错误;
故选C.
本题解析:
本题难度:一般