微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
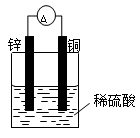
1、填空题 (9分)(1)按下图装置进行实验,可观察到的现象有: 。其中Zn极发生 反应(填“氧化”或“还原”),写出电极反应式 。
(2)有同学把Zn粒放入盛有稀盐酸的试管中,加入几滴CuCl2 溶液,气泡放出的速率加快。其原因是 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:a、b两个电极均由多孔的碳块组成。它的负极反应物为________,当正极消耗5.6 L(标准状况)气体时,外电路转移的电子数为________。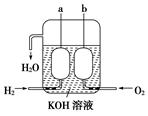
参考答案:(9分)(1)灵敏电流表的指针发生了偏转,锌片溶解,铜片上有气泡产生(2分)。
氧化(1分) Zn — 2e- ="=" Zn2+ (2分)
(2)锌-铜稀盐酸形成原电池,加快锌的氧化 ( 2分)
(3)H2 6.02×1023 (各1分,共2分)
本题解析:(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。锌比铜活泼,锌是负极,铜是正极,溶液中的氢离子在正极得到电子。
(2)锌能置换出铜,从而构成铜锌原电池,锌作负极,加快反应速率。
(3)氢气失去电子,所以氢气在负极通入,氧气在正极通入。因为1mol氧气得到4mol电子,所以转移的电子是5.6L÷22.4L/mol×4=1.0mol。
本题难度:一般
2、填空题 1991年我国首创以铝-空气-海水为能源的新型“海水电池”,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流。它比干电池能量高20~50倍。其总反应式表示为:4Al+3O2+6H2O===4Al(OH)3。
(1)该电源的负极材料为 ,(2)写出正极反应式为 : 。
参考答案:(1)铝 (2) O2+2H2O+4e-===4OH-
本题解析:(1)原电池中,负极发生氧化反应;根据题意知,该电池以海水为电解质溶液,靠空气中的氧使铝不断氧化而产生电流,则负极材料为铝;(2)原电池工作时,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-。
考点:考查原电池原理的应用。
本题难度:一般
3、选择题 把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池.若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极.则四种金属的活泼性顺序由大到小排列为( )
A.A>C>D>B
B.A>C>B>D
C.B>D>C>A
D.A>B>C>D
参考答案:原电池中,若A、B相连时,A为负极,说明活泼性A>B,C、D相连,D上有气泡逸出,说明D做原电池的正极,C是负极,所以活泼性时C>D,A、C相连时A极减轻,所以A是负极,所以活泼性是A>C,B、D相连,B为正极,所以活泼性是D>B,总上可知金属的活泼性顺序是:A>C>D>B.
故选A.
本题解析:
本题难度:简单
4、填空题 工业上生产氯气,常用电解槽中电解饱和食盐水,为了避免电解产物之间发生反应,常用阳离子交换膜将电解槽隔成两部分。下图(左图)为电解槽的示意图。
⑴这种阳离子交换膜,只允许溶液中的?通过。(填下列微粒的编号)
①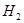 ?②
?②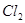 ?③
?③ ?④
?④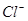 ?⑤
?⑤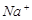 ?⑥
?⑥
⑵写出在电解过程中阳极发生的电极方程式:?。
⑶已知某电解槽每小时加入10%的氢氧化钠溶液10kg,每小时能收集到标况下的氢气896L,而且两边的水不能自由流通。则理论上计算,电解后流出的氢氧化钠溶液的质量分数为?。
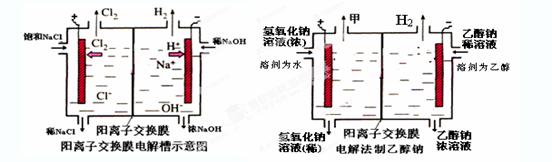
⑷某化学课外兴趣小组设计了用电解法制取乙醇钠的工业方法,所用的电解槽如上右图所示,设计要求:①所用的交换膜不能让分子自由通过;②电解过程中消耗的原料是氢氧化钠和乙醇。回答下列问题:
写出在电解过程中阳极发生的电极方程式?。
②最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:?。
(5)如图所示的是一个燃料电池的示意图,当此燃料电池工作时,
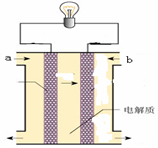
①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式:?
②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:?
参考答案:(1)③⑤; (2)阳极:2Cl─-2e-=Cl2; (3)35.7%;
(4)①阳极:4OH-+4e-=2H2O+O2↑;②蒸发结晶
(5) ①H2+2OH--2e-=2H2O ;②CH4+10OH-+8e-=CO32-+7H2O
本题解析:⑴这种阳离子交换膜,只允许溶液中的阳离子H+、Na+通过,所以选项是③⑤; ⑵写出在电解过程中阳极上阴离子放电。由于放电能力Cl->OH-,所以在阳极上发生的电极方程式:2Cl─-2e-=Cl2;(3)n(H2)=896L÷22.4L/mol=40mol.及氢气的质量是80g,所以根据电解的方程式:2NaCl+2H2O Cl2↑+H2↑+2NaOH可知会产生80mol的NaOH,其质量是80mol×40g/mol=3200g。溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×(896L÷22.4L/mol)× 23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,所以电解后流出的氢氧化钠溶液的质量分数为(4200g÷11760g)×100%35.7%;(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+ 2e-=2CH3CH2O-+H2↑在电解过程中阳极上OH-失去电子被氧化为氧气,发生的电极方程式是4OH-+ 4e-=2H2O+O2↑;②因为乙醇钠是盐,沸点较高,而乙醇是有分子构成的物质,沸点较低,所以最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:蒸发结晶。(5)在燃料电池中通入燃料的电极是负极,发生氧化反应,通入空气或氧气的电极为正极,在正极上发生还原反应。①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式是H2+2OH--2e-=2H2O ;②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:CH4+10OH-+8e-=CO32-+7H2O
Cl2↑+H2↑+2NaOH可知会产生80mol的NaOH,其质量是80mol×40g/mol=3200g。溶液增加的质量为增加的钠元素的质量减去生成氢气的质量=2×(896L÷22.4L/mol)× 23g/mol-80g=1760g;溶液中溶质氢氧化钠的质量为10000g×10%+3200g=4200g,溶液的质量为10000g+1760g=11760g,所以电解后流出的氢氧化钠溶液的质量分数为(4200g÷11760g)×100%35.7%;(4)①电解池中和电源的负极相连的是电解池的阴极,阴极上乙醇得电子发生还原反应,即2CH3CH2OH+ 2e-=2CH3CH2O-+H2↑在电解过程中阳极上OH-失去电子被氧化为氧气,发生的电极方程式是4OH-+ 4e-=2H2O+O2↑;②因为乙醇钠是盐,沸点较高,而乙醇是有分子构成的物质,沸点较低,所以最后从乙醇钠的乙醇溶液中分离得到纯净乙醇钠固体的方法是:蒸发结晶。(5)在燃料电池中通入燃料的电极是负极,发生氧化反应,通入空气或氧气的电极为正极,在正极上发生还原反应。①如果a极通入H2,b极通入O2,NaOH溶液作电解质溶液,则负极发生的电极方程式是H2+2OH--2e-=2H2O ;②如果a极通入CH4,b极通入O2,NaOH作电解质溶液,则负极发生的电极方程式:CH4+10OH-+8e-=CO32-+7H2O
本题难度:一般
5、选择题 有关如图原电池的说法正确的是
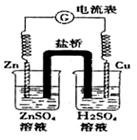
A.盐桥的作用是让电子通过,以构成闭合回路
B.总反应为:2H++Zn=H2+Zn2+且△H<0
C.随着反应进行,右烧杯中溶液pH变小
D.随着反应进行,左烧杯溶液中的SO42-向右烧杯溶液迁移
参考答案:B
本题解析:略
本题难度:简单