微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,能够说明反应2NO(g)?N2(g)+O2(g)已达到平衡的是( )
①容器内的压强不发生变化
②NO、N2、O2的浓度保持不变
③NO分解的速率和NO生成的速率相等
④单位时间内分解4molNO,同时生成2molN2
⑤混合气体的颜色不再改变的状态
⑥生成NO的速率是生成O2速率的2倍.
A.①③④
B.①④⑥
C.②③⑥
D.②③⑤
2、填空题 已知2SO2(g)+O2(g) 2SO3(g);△H<0的实验数据如下表:
2SO3(g);△H<0的实验数据如下表:
温度
| 不同压强下SO2的转化率(%)
|
1×105Pa
| 5×105Pa
| 1×106Pa
| 5×106Pa
| 1×107Pa
|
450℃
| 97.5
| 98.9
| 99.2
| 99.6
| 99.7
|
550℃
| 85.6
| 92.9
| 94.9
| 97.7
| 98.3
|
(1)应选的温度是?。
(2)应采用的压强是?,理由是?。
(3)在合成的SO3过程中,不需要分离出SO3的原因是?。
3、选择题 下列图像及对应说法正确的是(?)
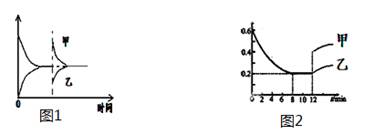
A.图1表示恒温恒压下条件,向2HI  H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率
H2 + I2 ΔH>0的反应达到平衡的容器中充入HI,甲表示正反应速率,乙表示逆反应速率
B.图1表示恒容下条件,向2HI  H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率
H2 + I2 ΔH>0的 反应达到平衡的容器加热,甲表示正反应速率,乙表示逆反应速率
C.图2表示恒温条件下,压缩2SO3(g) 2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化
2SO2(g)+O2(g) ΔH>0平衡反应体系,甲表示的SO3物质的量的变化,乙表示的SO3物质的量浓度的变化
D.图2表示恒容条件下,对于2SO3(g) 2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化
2SO2(g)+O2(g) ΔH>0反应平衡体系,甲表示升高温度SO3物质的量的变化,乙表示增加O2后SO3物质的量变化
4、填空题 硫一碘循环分解水制氢的主要反应如下:
(1)上述循环反应的总反应可以表示为____________________;反应过程中起催化作用的物质是__________(选填编号)。
a.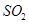 ? b.
? b.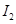 ? c.
? c.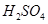 ? d.HI
? d.HI
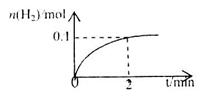
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,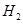 的物质的量随时间的变化如图所示。0~2min内的平均反应速率
的物质的量随时间的变化如图所示。0~2min内的平均反应速率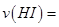 _________。
_________。
(3)对反应II,在相同温度和体积下,若开始加入的HI(g)的物质的量是原来的2倍,则以下_________也是原来的2倍(选填编号),
a.平衡常数? b.HI的平衡浓度
c.达到平衡时间? d.平衡时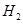 的体积分数
的体积分数
(4)实验室用锌和稀硫酸反应制取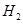 ,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生
,反应时溶液中水的电离平衡______移动(选填“向左”、“向右”或“不”);若加入少量下列试剂中的_____(选填编号),产生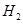 的速率将增大。
的速率将增大。
a. ? b.
? b.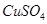 ? c.
? c.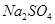 ? d.
? d.
5、选择题 在一定温度下,可逆反应N2(g)+3H2(g)?2NH3(g)达到平衡状态的标志是( )
A.氨气生成的速率与氮气分解的速率相等?
B.氮气、氢气、氨气的浓度不再变化?
C.单位时间内,生成n?mol?氮气,同时生成3n?mol?氢气?
D.氮气、氢气、氨气分子数之比为1:3:2?