微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)氨既是实验室中常用试剂,也是工业上重要原料。
(1)某学习小组欲制备少量的氨水。供选用的试剂有:
①NH4Cl ②(NH4)2CO3 。提供的装置如下,请回答下列问题:
①装置A试管内发生反应的化学方程式为 ;
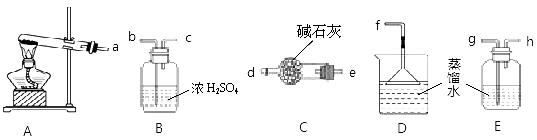
②从提供的仪器中选择并组装一套本实验的合理、简洁装置,按气流方向连接顺序为(用图中标注的导管口符号表示)a→ ;
(2)氨在氧气中燃烧,生成水和一种单质。
已知: N2(g)+3H2(g)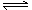 2NH3(g) △H= -92.4kJ·mol-1
2NH3(g) △H= -92.4kJ·mol-1
2H2(g)+ O2(g)= 2H2O(l) △H= -572kJ·mol-1
写出氨在氧气中燃烧生成液态水和气态单质的热化学方程式: ;
(3)已知在一定条件下,将1molN2和3molH2混合于一个10L的密闭容器中发生的
反应为N2+3H2 2NH3,5min后达到平衡,平衡时氨的体积分数为25%。
2NH3,5min后达到平衡,平衡时氨的体积分数为25%。
①该反应的平衡常数表达式K = ;
②从反应开始到平衡时,N2的反应速率 (N2)= _________________;
(N2)= _________________;
(4)工业上以氨气、空气为主要原料制取硝酸。在容积恒定的密闭容器中进行反应2NO(g)+O2(g) 2NO2(g) △H>0。该反应的反应速率(
2NO2(g) △H>0。该反应的反应速率( )随时间(
)随时间(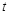 )变化的关系如图所示。若
)变化的关系如图所示。若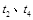 时刻只改变一个条件,下列说法正确的是(填选项序号) 。
时刻只改变一个条件,下列说法正确的是(填选项序号) 。

A.在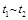 时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
B.在 时,采取的措施可以是升高温度
时,采取的措施可以是升高温度
C.在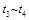 时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
D.在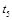 时,容器内
时,容器内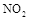 的体积分数是整个过程中的最大值
的体积分数是整个过程中的最大值
(5)为检验氨气与酸反应得到的某种常见氮肥的成分,某同学进行了以下实验:
①加热氮肥样品产生气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分可能是_____________(填选项序号);
A.NH4Cl B.(NH4)2CO3 C.NH4HCO3 D.NH4NO3
(6)硝酸厂常用Na2CO3溶液吸收处理尾气NO2生成CO2。若9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,则反应的离子方程式是:
。
参考答案:(1)①(NH4)2CO3 2NH3↑+CO2↑+H2O;②e d f;(2)4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H="-1531.2" kJ?mol-1;(3)①K=
2NH3↑+CO2↑+H2O;②e d f;(2)4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H="-1531.2" kJ?mol-1;(3)①K=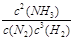 ;②0.008mol/(L
;②0.008mol/(L
本题解析:
本题难度:困难
2、选择题 一定条件下,可逆反应2A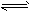 B+3C,在下列四种状态中处于平衡状态的是
B+3C,在下列四种状态中处于平衡状态的是
[? ]
正反应速率 逆反应速率
A.v(A)=2mol/(L·min) v(B)=2mol/(L·min)
B.v(A)=2mol/(L·min) v(C)=2mol/(L·min)
C.v(A)=1mol/(L·min) v(B)=2mol/(L·min)
D.v(A)=1mol/(L·min) v(C)=1.5mol/(L·min)
参考答案:D
本题解析:
本题难度:一般
3、选择题 可逆反应mA(s)+nB(g)?eC(g)+fD(g)在反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示.下列叙述正确的是( )

A.达到平衡后,若增大压强,混合气体的平均相对分子质量一定增大
B.当平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,n>e+f
D.达到平衡后,增加A,则B的转化率增大
参考答案:B
本题解析:
本题难度:简单
4、选择题 已知某化学反应的平衡常数表达式为K=
,在不同的温度下该反应的平衡常数值分别为:
| t℃ | 700 | 800 | 830 | 1000 | 1200
K
1.67
1.11
1.00
0.60
0.38
|
下列有关叙述错误的是( )
A.该反应的化学方程式是:CO(g)+H2O(g)?CO2(g)+H2(g)
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入CO和H2O各1 mol,再把温度升高到830℃,此时测得CO2为0.4 mol时,这时可逆反应处于平衡状态
D.若平衡浓度关系符合=,可判断此时温度是1000℃
参考答案:A、依据平衡常数的表达式可知反应物是一氧化碳和水,生成物是二氧化碳和氢气,该反应的化学方程式是:CO(g)+H2O(g)?CO2(g)+H2(g),故A正确;
B、表中数据分析,温度越高,平衡常数越小,则所以反应是放热反应,故B正确;
C、CO(g)+H2O(g)?CO2(g)+H2(g)? 反应是一定体积容器中设为1L
起始量(mol)?0?0?1?1
变化量(mol)? 0.4? 0.4? 0.4? 0.4
5nim的量(mol) 0.4? 0.4? 0.6? 0.6
Qc=[CO2][H2][CO][H2O]=0.6×0.60.4×0.4>1,830°C时Qc不等于K,说明反应未达到平衡,故C错误;
D、关系式:c(CO2)3c(CO)=c(H2O)5c(H2)得到[CO2][H2][CO][H2O]=0.6,对照平衡常数可知温度是1000℃,故D正确;
故选C.
本题解析:
本题难度:简单
5、填空题 “富煤、贫油、少气”是我国能源发展面临的现状。随着能源的日益紧张,发展“煤化工”对我国能源结构的调整具有重要意义。下图是煤化工产业链之一。
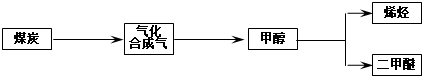
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出热值很高的煤炭合成气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol
参考答案:
本题解析:
本题难度:困难