微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 如图所示,甲、乙之间的隔板K可以左右移动,甲中充入2molA和1molB,乙中充入2molC和1molHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)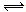 2C(g),反应达到平衡后,恢复到反应发生前时的温度。
2C(g),反应达到平衡后,恢复到反应发生前时的温度。
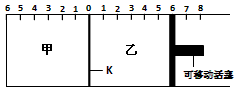
填写下列有关空白:
(1) 根据隔板K滑动与否______(填“能”或“不能”) 判断左右两边的反应是否达到平衡。
(2) 达到平衡后,隔板K最终停留在左侧刻度__________位置。
(3) 到达平衡时,甲容器中A的物质的量______乙容器中A的物质的量(填“>”、“<”或“=”)。
(4) 若平衡时K停留在左侧1处,则活塞仍停留在右侧______(填序号)。
A.右侧6处 B.右侧6~7处 C.右侧7处 D.右侧7~8处
参考答案:(1)能
(2) 0~2
(3) <
(4) B
本题解析:
本题难度:一般
2、选择题 .可逆反应达到平衡的根本原因是(?)
A反应混合物中各组分的浓度相等? B.正逆反应都还在继续进行
C.正逆反应的速率均为零? D.正逆反应的速率相等
参考答案:D
本题解析:可逆反应达到平衡的根本原因是正逆反应的速率相等,且不为0,所以选项D正确,答案选D。
本题难度:简单
3、填空题 分人工固氮是指将氮元素由游离态转化为化合态的过程。据报道,常温、常压、光照条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成的主要产物为NH3,相应的热化学方程式为:N2(g)+3H2O(l) 2NH3(g)+
2NH3(g)+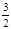 O2(g)? △H="+765.0kJ" /mol。
O2(g)? △H="+765.0kJ" /mol。
Ⅰ.请在下图所示的坐标中画出上述反应在有催化剂和无催化剂两种情况下反应体系中的能量变化示意图,并进行标注(包括△H)。

Ⅱ.目前工业合成氨的原理是:N2(g)+ 3H2(g) 2NH3(g)? △H=-93.0kJ /mol。
2NH3(g)? △H=-93.0kJ /mol。
回答下列问题:
(1)氢气的燃烧热△H=_______________kJ/mol。
(2)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
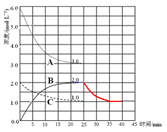
(3)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
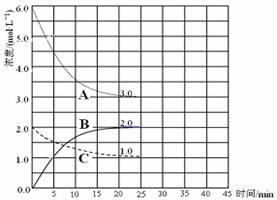
① 表示N2的浓度变化的曲线是?(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是?。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = ?(计算结果可用分数表示)。若升高温度,该反应的平衡常数值将_______(填“增大”、 “减小”或“不变”)。
(4)在第25 min 末,保持其它条件不变,若升高反应温度并设法保持该温度不变,在第35 min末再次达到平衡。平衡移动过程中H2浓度变化了1.5 mol·L-1,请你在图中画出第25 min ~ 40 min NH3浓度变化曲线。
(5)在一定温度下,将1 mol N2和3 mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8 mol 。
①达平衡时,H2的转化率α1 = ____________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率为α2,当α1 + α2 =1时,则起始时n (NH3)= ________mol。
参考答案: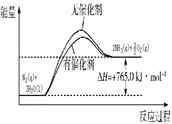 或
或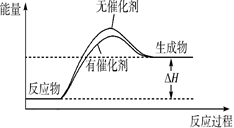
Ⅱ. (1)-286.0(1分)
(2) a c? (每个1分,共2分,有错不得分。)
(3)① C (1分)? ② 0.12 mol·L-1·min-1(2分)
③ 4/27 (或0.148、0.15) (2分,写单位也得分)?减小(1分)
(4)
(5)① 60%(2分)? ② 2(1分)
本题解析:Ⅰ.催化剂可以降低反应的活化能,加快反应速率,但不能改变反应热,据此可以作图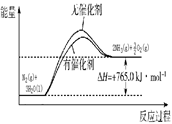 或
或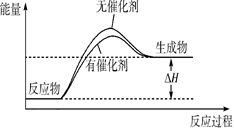 。
。
Ⅱ.(1)根据盖斯定律可知,(②-①)÷3即得到H2(g)+1/2O2(g) H2O(l),所以该反应的反应热是△H=(-93.0kJ /mol-765.0kJ /mol)÷3=-286.0 kJ /mol,所以氢气的燃烧热是△H=-286.0 kJ /mol。
H2O(l),所以该反应的反应热是△H=(-93.0kJ /mol-765.0kJ /mol)÷3=-286.0 kJ /mol,所以氢气的燃烧热是△H=-286.0 kJ /mol。
(2)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项c可以说明。该反应是体积减小的可逆反应,所以当压强不再发生变化时,可以说明,a正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,b不正确。D中反应速率的方向是相同的,不正确。速率之比是相应的化学计量数之比,因此e中的关系始终是成立,不正确,因此答案选ac。
(3)①根据图像可知,反应进行到25min时物质的浓度不再发生变化,此时ABC的浓度变化量分别是(mol/L)A减少3.0,B增加2.0,C减少1.0,所以表示N2的浓度变化的曲线是C,表示H2的浓度变化的曲线是A,表示氨气的浓度变化的曲线是B。
②前25 min 内,用H2的浓度变化表示的化学反应平均速率是3.0mol/L÷25min=0.12 mol·L-1·min-1。
③根据平衡常数的表达式可知,该反应的K=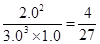 。由于正方应是放热反应,所以若升高温度,平衡向逆反应方向移动,该反应的平衡常数值将减小。
。由于正方应是放热反应,所以若升高温度,平衡向逆反应方向移动,该反应的平衡常数值将减小。
(4)升高温度,反应速率增大,但平衡向逆反应方向移动,所以根据氢气的浓度变化量可知,平衡时氨气的浓度应该是1.0mol/L,所以该图应该是(见答案)。
(5)①? N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始量(mol)? 1? 3? 0
转化量(mol)? x? 3x? 2x
平衡量(mol) 1-x? 3-3x? 2x
则1-x+3-3x+2x=2.8
解得x=0.6
所以氢气的转化率是60%。
②α1 + α2 =1,所以氨气的转化率是40%,则
N2(g)+ 3H2(g) 2NH3(g)
2NH3(g)
起始量(mol)? 0? 0? y
转化量(mol)? 0.2y? 0.6y? 0.4y
平衡量(mol)? 0.2y? 0.6y? y-0.4y
则0.2y+0.6y+y-0.4y=2.8
解得y=2
点评:该题以化学反应速率和化学平衡为载体,重点考查学生灵活运用基础知识解决实际问题的能力。试题综合性强,贴近高考,易于激发学生的学习兴趣和学习求知欲。有利于培养学生的逻辑推理能力和应试能力,提高学生的规范答题能力和学习效率。
本题难度:困难
4、填空题 (8分)现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加入B(体积不变),则A的转化率_________,B的转化率_________。(填“增大”“减小”或“不变”,下同)
(3)若升高温度,则平衡时B、C的浓度之比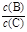 将_________。
将_________。
参考答案:(8分)(1) >? (2)增大?减小? (3)减小
本题解析:(1)当升高温度时,B的转化率变大,所以正反应是吸热反应;当减小压强时,混合体系中C的质量分数减小,说明正反应是体积减小的反应,所以m+n>P。
(2)增大B的浓度,平衡向正反应方向移动,所以A的转化率增大,但B的转化率减小。
(3)正反应是吸热的,所以升高温度,平衡向正反应方向移动,因此B、C的浓度之比将减小。
本题难度:一般
5、选择题 有关工业合成氨的反应:N2+ 3H2  2 NH3的说法不正确的是(? )
2 NH3的说法不正确的是(? )
A.该反应为可逆反应,故在一定条件下N2和H2不可能全部转化为NH3
B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零
C.一定条件下,向某密闭容器中加入1mol N2和3mol H2,则从反应开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等
D.在利用上述反应生产NH3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题
参考答案:B
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以选项B是错误的,其余选项都是正确的,答案选B。
点评:该题是基础性试题的考查,也是反应速率、平衡状态在实际工业生产中的综合应用。有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般