微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、计算题 工业上有一反应2A(g)+B(g) 3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
3C(g),按体积比为A∶B=5∶2将A和B充入到一定容积的密闭容器中,若在恒温条件下达到平衡时C占总体积的60%,设A,B,C的相对分子质量分别用a,b,c表示。试求:
(1)平衡时A和B的转化率。
(2)平衡时混合气体的平均分子量。
参考答案:(1)平衡时A的转化率为56%;B的转化率70%;
(2)平衡时混合气体的平均分子量为(5a+2b)/7。
本题解析:(1)设A=5V,则B=2V。
设B转化了x,则有:
2A(g)+B(g) 3C(g)
3C(g)
起始 5V 2V? 0
转化 2x x 3x?
平衡 5V-2x 2V-x 3x
依题意有:
(3x)/[(5V-2x)+(2V-x)+3x]
?=(60/100)=(3/5)
即有:(3x/7V)=(3/5)
解得:x=(7V/5)
∴A的转化率为:
A%=(2x/5V)×100%=(2×7/5V)/5V×100%
?=56%
B的转化率为
B%=(x/2V)×100%=(7/5V)/2V×100%=70%
(2)混合气体平衡时的总体积V总=7L
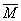 =(5aL+2bL)/7L=(5a+2b)/7
=(5aL+2bL)/7L=(5a+2b)/7
本题难度:简单
2、选择题 在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同温度下任其发生反应:A2(g)+2B2(g)2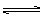 AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成图,不正确的叙述是
AB2(g),分别在某时刻测得其中AB3所占的体积分数绘成图,不正确的叙述是
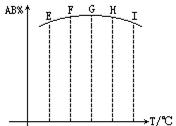
A.反应是放热反应
B.E、F二点尚未达到平衡状态
C.H、I二点尚未达到平衡状态
D.G、H、I三点功能已达平衡状态
参考答案:C
本题解析:随着温度的升高反应速率加快,从G到H、I,AB3%所占的体积分数降低,能得出正反应是放热反应;E、F两点AB3%比G点低,原因是低温下反应速率慢,反应未达平衡状态,选C。
本题难度:一般
3、选择题 NH3氧化制硝酸时,在吸收塔里发生如下反应:3NO2+3H2O 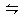 2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是(?)
2HNO3+NO △H<0,为了提高HNO3的产量,在理论上应该采取的措施是(?)
A.降温
B.升温
C.减压
D.增压
参考答案:AD
本题解析:依据反应的特点,要使平衡向有利于HNO3的产量的增大的方向移动,可采取降温和加压的措施。
本题难度:一般
4、选择题 在一个容积为VL的密闭容器中放入2LA(g)和1L?B(g),在一定条件下发生下列反应:3A(g)+B(g)?nC(g)+2D(g),达到平衡后,A物质的量浓度减小
,混合气体的平均摩尔质量增大,则该反应的化学方程式中n的值是( )
A.1
B.2
C.3
D.4
参考答案:在一个容积为VL的密闭容器中放入2LA(g)和1L?B(g),在一定条件下发生下列反应:3A(g)十B(g)?nC(g)+2D(g),
达到平衡后,混合气体的平均摩尔质量增大,由M=mn可知,
A、B、C、D均为气体,由质量守恒定律可知,气体的总质量不变,
则该反应为气体体积缩小的反应,
即3+1>n+2,
所以n<2,
故选A.
本题解析:
本题难度:一般
5、选择题 在2NO2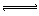 N2O4的可逆反应中,下列状态属平衡状态的是
N2O4的可逆反应中,下列状态属平衡状态的是
A.混合物中,NO2的百分含量不再改变的状态
B.NO2的分子数与N2O4分子数的比值为2∶1的状态
C.体系的颜色不再发生变化的状态
D.NO2全部转变成N2O4的状态
参考答案:A、C
本题解析:平衡时,各组分的百分含量保持不变,但并不一定存在[NO2]等于[N2O4],或二者分子数之比为2∶1的情况,所以B错误,A正确。
由于该反应是可逆反应,反应不能进行到底,达平衡时,存在着反应物与生成物共存的体系。故D错误。
对于2NO2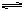 N2O4这个具体的反应而言,由于NO2呈棕色而N2O4无色,达平衡时各组分的百分含量保持不变,体系的颜色也就不再改变。
N2O4这个具体的反应而言,由于NO2呈棕色而N2O4无色,达平衡时各组分的百分含量保持不变,体系的颜色也就不再改变。
本题难度:一般