| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《物质的组成》高频考点预测(2017年最新版)(二)
(5)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为?(用对应的元素符号表示)。 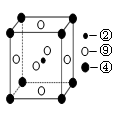 参考答案:(1)⑨?(1分) 本题解析:(1)区的名称来自按照构造原理最后通入电子轨道的能级名称,所以属于d区的是⑨,即镍元素。 本题难度:一般 4、选择题 下各各微粒半径依次增加的是(?) 参考答案:B 本题解析:略 本题难度:简单 5、选择题 据报道,某些建筑材料会产生放射性氡 参考答案:B 本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。又因为质子数+中字数=质量数,所以放射性同位素 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点讲解《离子反应》.. | |