微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (12分)
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
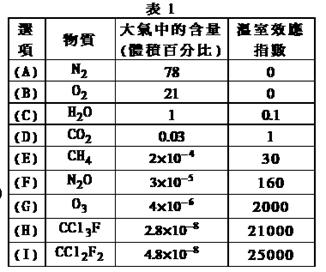
(1)下列由极性键形成的非极性分子是?。
A.N2? B.O2? C.H2O? D.CO2 ?E.CH4
(2)下列说法正确的是?。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是?。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手 性异构
性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的?。
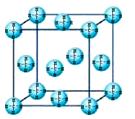
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为?。?
A.[ CoCl2(NH3)4 ]Cl·NH3·H2O? B.[ CoCl(NH3)5]Cl2·H2O
C.[ CoCl2(NH3)3(H2O)]Cl·2NH3?D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为:?。
参考答案:
本题解析:略
本题难度:一般
2、选择题 有a、b、c、d四种金属,用导线两两相连插入稀硫酸中可以组成原电池, a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,a极发生氧化反应;b、d相连时,b极有大量气泡生成。则四种金属的活动性按由强到弱顺序排列的是(? )
A.a>b>c>d
B.a>c>d>b
C.c>a>b>d
D.b>d>c>a
参考答案:B
本题解析:考查金属活动性比较。在原电池中较活泼的金属作负极,方式氧化反应,电子从负极通过导线流向正极,而电流方向正好相反。、b相连时,a为负极,则活泼性a大于b。c、d相连时,电流由d到c,说明d是正极,活泼性是c大于d。a、c相连时,a极发生氧化反应,a是负极,活泼性是a大于c。b、d相连时,b极有大量气泡生成,说明b是正极,氢离子放电生成氢气,活泼性是d大于b,综上所叙活泼性顺序为a>c>d>b。
本题难度:一般
3、填空题 (15分)已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中,都有两个未成对的电子,C、D同主族。 E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
⑴基态D原子中,电子占据的最高能层符号?,该能层具有的原子轨道数为?;
⑵E2+离子的价层电子排布图是?,F原子的电子排布式是?;
⑶A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为?,? B元素的气态氢化物的VSEPR模型为?;
⑷化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为?;
⑸配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为?;
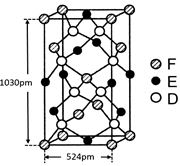
⑹某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为?,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
d=?g/cm3。
参考答案:⑴M?9个?⑵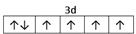 ? 1s22s22p63s23p63d104s1 (或[Ar]3d104s1) ;
? 1s22s22p63s23p63d104s1 (或[Ar]3d104s1) ;
⑶ sp2 ; 四面体 ;⑷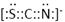 ; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;
; ⑸3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;
⑹CuFeS2?;?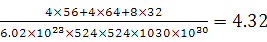
本题解析:根据题意可得A是C;B是N;C是O;D是S;E是Fe;F是Cu。⑴基态S原子核外电子排布是1s22s22p63s23p4,可见电子占据的最高能层是M层;在M能层有1个s轨道、3个p轨道、5个d轨道,一共具有的原子轨道数是9个。⑵Fe2+离子的价层电子排布图是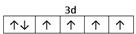 ;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar]3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为
;根据能层排布规律可知:29号元素Cu原子的电子排布式是1s22s22p63s23p63d104s1 (或[Ar]3d104s1);⑶C元素的最高价氧化物对应的水化物H2CO3中心原子C采取的轨道杂化方式为sp2杂化;N元素的气态氢化物的VSEPR模型为四面体型。⑷化合物CO2、N2O和阴离子SCN-互为等电子体,物质的结构相似。性质也相似。它们结构相似,SCN-的电子式为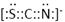 。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6] 3+。配合物甲的化学式是K3[Fe(CN)6]. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6].溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2?;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:
。⑸配合物甲的焰色反应呈紫色说明含有K+;其内界由中心离子Fe3+与配位体CN-构成,配位数为6,该离子是[Fe(CN)6] 3+。配合物甲的化学式是K3[Fe(CN)6]. 检验Fe2+离子的检验方法是向待测溶液中加入K3[Fe(CN)6].溶液,若产生具有特征蓝色的铁氰化亚铁沉淀,就证明含有Fe2+,其离子方程式为3Fe2++2Fe(CN)63-=Fe3[Fe(CN)6]2↓ ;⑹某种化合物由D,E,F三种元素组成,由其晶胞示意图可知:含有S:8; Fe:8×1/8+6×1/2=4;Cu:8×1/8+4×1/2+1=4,所以Fe:Cu:S=4:4:8=1:1:2则其化学式为CuFeS2?;该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度: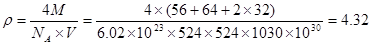 g/cm3。
g/cm3。
本题难度:一般
4、选择题 下列有关碱金属铷(Rb)的叙述中,正确的是
A.硝酸铷是离子化合物,易溶于水
B.氢氧化铷是弱碱
C.在钠、钾、铷三种单质中,铷的熔点最高
D.铷在氧气中燃烧,产物为Rb2O
参考答案:A
本题解析:A、根据硝酸钠是离子化合物推知硝酸铷是离子化合物,故A正确;
B、氢氧化钠是强碱,同主族从上到下,元素最高价氧化物对应水化物碱性增强,所以氢氧化铷是强碱,故B错误;
C、第ⅠA族元素单质的熔点是逐渐降低的,钠、钾、铷三种单质中,铷的熔点最低,故C错误;
D、根据钾在氧气中燃烧产物是超氧化钾,可以推测Rb在氧气中燃烧,产物为RbO2,故D错误。
故选A。
点评:本题涉及元素周期律知识的考查,同主族元素的性质具有相似性和递变性,注意知识的迁移应用,难度不大。
本题难度:一般
5、选择题 有关元素X、Y、Z、W的信息如下
元素
| 有关信息
|
X
| 所在主族序数与所在周期序数之差为4
|
Y
| 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子
|
Z
| 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏
|
W
| 地壳中含量最高的金属元素
|
请回答下列问题:
(1)?W的单质与Y的最高价氧化物对应的水化物反应的离子方程式为_______________。
(2)?铜片、碳棒和ZX3溶液组成原电池,写出正极发生的电极反应方程式
_______________________________________________ 。
(3)?向淀粉碘化钾溶液中滴加几滴ZX3的浓溶液,现象为_____________________,相关反应的离子方程式为_______________________________。
(4)?以上述所得WX3溶液为原料制取无水WX3,先制得WX3·6H2O晶体,主要操作包括__________________________,在_____________________条件下加热WX3·6H2O晶体,能进一步制取无水WX3,其原因是(结合离子方程式简要说明)_______________________________。
参考答案:1)2Al + 2OH- + 2H2O = 2AlO2- + 3H2↑?(2分)

 (2)2Fe3+ + 2e-?2Fe2+? (或Fe3+ + e-?Fe2+)?(2分)?
(2)2Fe3+ + 2e-?2Fe2+? (或Fe3+ + e-?Fe2+)?(2分)?
(3)(2分)溶液变为蓝色?(2分)? 2Fe3+ + 2I- = 2Fe2+ + I2?(2分)
(4)加热浓缩、冷却结晶、过滤?(2分)?干燥的HCl气流(2分)?
 ? Al3+ + 3H2O? Al(OH)3 + 3H+,在干燥的HCl气流中,抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水气,故能得到AlCl3。?(3分)
? Al3+ + 3H2O? Al(OH)3 + 3H+,在干燥的HCl气流中,抑制AlCl3的水解,且带走AlCl3·6H2O晶体受热产生的水气,故能得到AlCl3。?(3分)
本题解析:略
本题难度:一般