微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如图为用惰性电极电解CuCl2溶液,并验证其产物的实验装置,则下列说法不正确的是 (?)
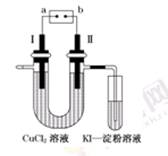
A.电源a极为负极
B.KI—淀粉溶液会变蓝
C.可以将惰性电极Ⅰ换为铜棒
D.惰性电极Ⅰ上发生的电极反应为:Cu-2e-=Cu2+
参考答案:D
本题解析:根据实验装置,可以判断Ⅱ电极产生氯气,即a极是负极.电极Ⅱ处产生氯气,KI-淀粉溶液会变蓝.电极Ⅰ是阴极,用铜棒不会影响电解。故选D。
本题难度:一般
2、填空题 工业上用电解饱和食盐水的方法生产氯气和烧碱.
(1)食盐溶于水发生电离,其电离方程式为______
(2)电解食盐水的原理是:
______NaCl+______H2O
______H2↑+______Cl2↑+______NaOH
(将上述化学方程式中各物质的化学计量数填在横线上)
(3)2004年4月15日,某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理为______(用离子方程式表示).
(4)事件过后,附近居民向记者反映当时晾在外面的衣服褪色了,其原因是______(结合化学方程式解释).
参考答案:(1)氯化钠是强电解质,在水分子作用下完全电离出阴阳离子,所以其电离方程式为:NaCl=Na++Cl-,
故答案为:NaCl=Na++Cl-;
(2)电解饱和食盐水生产烧碱(NaOH),同时生成氯气(Cl2)和氢气,从生成物氢气和氯气开始配平,生成1分子氢气需要得到2个电子,生成1分子氯气需要失去2个电子,得失电子相等,然后观察法配平,该反应的化学方程式为:2NaCl+2H2O电解.2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O电解.2NaOH+Cl2↑+H2↑;
(3)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气和水反应生成次氯酸,反应方程式为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白,所以能使湿衣服褪色,
故答案为:Cl2+H2O=HCl+HClO,HClO具有强氧化性,可漂白有色物质.
本题解析:
本题难度:一般
3、选择题 如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。下列说法中不正确的是

[? ]
A.X是正极,Y是负极
B.X是负极,Y是正极
C.a极和Pt都有气泡产生
D.U形管中溶液的碱性增强
参考答案:A
本题解析:
本题难度:一般
4、选择题 将0.1 L含有0.02mol CuSO4和0.01mol NaCl的水溶液用惰性电极电解。电解一段时间后,一个电极上得到0.01 mol Cu,另一电极析出的气体
A.只有Cl2
B.只有O2
C.只有H2
D.既有Cl2又有O2
参考答案:D
本题解析:放电顺序Cl->OH-,所以电解硫酸铜和氯化钠的混合溶液,阳极Cl-先放电,当Cl-电解完全析出Cl2后, 接着阳极OH-放电析出O2。所以当阴极析出0.01molCu时,转移电子0.02mol,而n(Cl-)=0.01mol,当全部析出Cl2时,转移电子仅有0.01mol,所以还会有0.0025molO2析出,故选D。
本题难度:一般
5、选择题 如图所示,各烧杯中盛有海水,铁(含杂质C)在其中被腐蚀由快到慢的顺序为( )
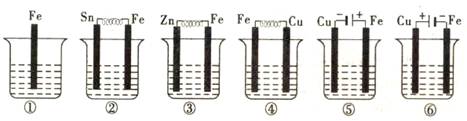
A.⑤④②①③⑥ B.⑤④③①②⑥ C.②①③④⑤⑥ D.⑤③②④①⑥
参考答案:A
本题解析:当铁作为电解池的阳极时,其腐蚀的速度是最快的,当作为电解池的阴极是,其腐蚀速率是最慢的,当铁与金属构成原电池时,铁作为负极时,两者金属的活动性相差越大,铁的腐蚀速率就越大,但铁作为负极时,即铁的腐蚀速率就会减慢,所以铁(含杂质C)在其中被腐蚀由快到慢为⑤④②①③⑥,故本题的答案选择A。
考点:原电池、电解池
点评:本题考查了原电池、电解池的运用,这些知识点是高考考查的重点和难点,本题难度适中,关键是要掌握当铁作为电解池的阳极时,其腐蚀的速度是最快的,当作为电解池的阴极是,其腐蚀速率是最慢的,当铁与金属构成原电池时,铁作为负极时,两者金属的活动性相差越大,铁的腐蚀速率就越大,但铁作为负极时,即铁的腐蚀速率就会减慢。
本题难度:简单