微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)
(1)已知1.505×1023个X气体分子的质量为8 g,则该X气体的物质的量为 ,其摩尔质量为 ;
(2)n g O2中有m个O原子,则阿伏加德罗常数NA的数值可表示为
参考答案:(8分) (1)0.25mol; 32g/mol ;(2) 16m/n
本题解析:考查物质的量的有关计算。
(1)根据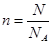 可知,1.505×1023个X气体分子的物质的量是1.505×1023÷6.02×1023/mol=0.25mol。又因为n=m/M,所以该气体的摩尔质量是8g÷0.25mol=32g/mol。
可知,1.505×1023个X气体分子的物质的量是1.505×1023÷6.02×1023/mol=0.25mol。又因为n=m/M,所以该气体的摩尔质量是8g÷0.25mol=32g/mol。
(2)ng氧气的物质的量是n/32mol,又因为氧气是由2个氧原子构成的,所以根据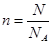 可知,阿伏加德罗常数NA的数值可表示为
可知,阿伏加德罗常数NA的数值可表示为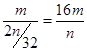 。
。
本题难度:一般
2、选择题 NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol Na与 O2完全反应生成Na2O或Na2O2均失去NA个电子
B.1mol Na2O2与足量CO2反应时,转移2NA个电子
C.1mol·L-1的NaOH溶液中含Na+数目为NA
D.23gNa+中含有的电子数为NA
参考答案:A
本题解析:A 正确,1 mol Na生成钠离子,都失去1mol电子,即均失去NA个电子
B 错误,1mol Na2O2与足量CO2反应时,转移NA个电子
C 错误,没有给溶液体积,无法求溶质的物质的量
D 错误,23gNa+中含有的电子数为10NA
本题难度:一般
3、选择题 某10% NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的NaOH溶液,则该20%NaOH溶液的物质的量浓度为
[? ]
A.6.25 mol/L
B.12.5 mol/L
C.7 mol/L
D.7.5 mol/L
参考答案:A
本题解析:
本题难度:一般
4、实验题 (13分)FeSO4?7H2O广泛用于医药和工业领域。以下是FeSO4?7H2O的实验室制备流程图。
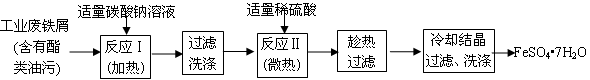
根据题意完成下列填空:
(1)碳酸钠溶液能除去酯类油污,是因为 (用离子方程式表示)。
(2)废铁屑中含氧化铁,无需在制备前除去,理由是(用离子方程式回答) , 。
以下是测定某补血剂(FeSO4?7H2O)中铁元素含量的流程图。根据题意完成下列填空:
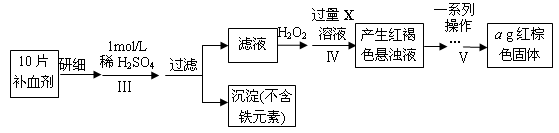
(3)步骤Ⅲ需要100mL1mol/L的稀硫酸,用98.3%,ρ=1.84g/cm3的浓硫酸配制,所用的仪器有量筒、烧杯、玻璃棒、胶头滴管及 。
(4)步骤Ⅴ一系列操作依次是:①过滤②洗涤③ ④冷却⑤称量⑥恒重操作。操作⑥的目的是 。
(5)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示)。
参考答案:(1)CO32—+H2O HCO3—+OH—;(2分)(2)Fe2O3 +6H+=2Fe3++3H2O(2分)
HCO3—+OH—;(2分)(2)Fe2O3 +6H+=2Fe3++3H2O(2分)
2Fe3+ +Fe=3Fe2+ (2分) (3) 100mL容量瓶 (1分) (4)③灼烧(加热)(2分)
恒重操作确保氢氧化铁完全分解成了氧化铁 (2分) (5) 0.07a(2分)
本题解析:(1)碳酸钠是强碱弱酸盐,水解溶液显碱性,因此可以除去油污,方程式为CO32—+H2O HCO3—+OH—;
HCO3—+OH—;
(2)氧化铁与稀硫酸反应生成硫酸铁,硫酸铁又与铁反应生成硫酸亚铁,因此废铁屑中含氧化铁,无需在制备前除去,反应的离子方程式为Fe2O3 +6H+=2Fe3++3H2O、 2Fe3+ +Fe=3Fe2+。
(3)配制100mL1mol/L的稀硫酸需要的仪器有量筒、烧杯、玻璃棒、胶头滴管及 100mL容量瓶。
(4)红褐色沉淀是氢氧化铁,灼烧即得到氧化铁。为保证氢氧化铁完全分解转化为氧化铁,需要恒重操作。
(5)氧化铁的质量是ag,则根据铁元素守恒可知每片补血剂含铁元素的质量= 。
。
考点:考查元素含量测定实验方案设计与探究
本题难度:困难
5、选择题 在含有Na+、Cl-、K+、SO42-的混合溶液中,测得c(Na+)=2mol/L,c(K+)=2mol/L,c(Cl-)=2mol/L,则c(SO42-)等于
A.1mol/L
B.0.5mol/L
C.1.5mol/L
D.2mol/L