对B电离的影响
取1mL用蒸馏水稀释为100mL溶液
取1mL用同浓度的C溶液稀释为100mL溶液
参考答案:(1)A、B、C三种化合物,都是由氢、氮、氧三种元素所组成,其中一种是弱电解质,推断为NH3?H2O,余均是强电解质.A和B可以通过复分解反应形成C.说明是酸和碱反应生成盐,可以推断AB为一水合氨和硝酸,反应生成硝酸铵,浓度均为amol?L-1的A、B、C三种稀溶液中,pH大小关系是pH(B)>pH(C)>pH(A).则A为HNO3;B为NH3?H2O;C为NH4NO3;
故答案为:HNO3,NH3?H2O,NH4NO3;
(2)A、B、C三种物质各自溶解在水中时,能使水的电离程度增大的是硝酸铵,铵根离子水解显酸性,反应的离子方程式为:NH4++H2O?NH3.H2O+H+;
故答案为:C;NH4++H2O?NH3.H2O+H+;
(3)若将a mol?L-1的B为NH3?H2O溶液进行下列实验,稀释促进一水合氨的电离平衡正向进行,平衡状态下的离子浓度减小,依据水溶液中的离子积常数氢氧根离子浓度增大,氢离子浓度减小;取1mL用同浓度的C溶液为NH4NO3稀释为100mL溶液,溶液中存在铵根离子对一水合氨的电离起到了抑制作用,氢氧根离子浓度减小,溶液中氢离子浓度增大;
故答案为:
项目c(H+)c(OH-)对B电离的影响取1mL用蒸馏水稀释为100mL溶液增大减小促进取1mL用同浓度的C溶液稀释为100mL溶液增大减小抑制
本题解析:
本题难度:一般
2、简答题 下面图表示制备无水盐E的主要步骤:
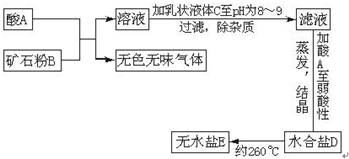
已知B是石灰石,D盐含有约49%的结晶水,无水盐E可用作干燥剂.取少量E溶于水,向其中滴加硝酸后,再滴加硝酸银溶液,有白色沉淀F生成.
填写以下空白(写出化学式或名称):
A______,C______,D______,E______,F______.
参考答案:这是一例典型的定性分析和定量分析相结合的推断题.
(一)定性分析:因为B是石灰石,和酸A反应,放出的无色无味气体应是CO2,生成可溶性钙盐,由此判定最终形成的无水盐E也是钙盐溶液,因为E溶于水后向其中滴加硝酸后,再滴加硝酸银溶液,有白色沉淀F生成,知F是AgCl,E是CaCl2,吻合了E可作干燥剂这条件,D是CaCl2的结晶水合物.
(二)定量分析:设无水盐为CaCl2?xH2O
? CaCl2?xH2O~xH2O
101+18x?18x ?
100?49
解之:x=6
则D盐化学式 CaCl2?6H2O酸A是盐酸,乳状液体C应是石灰乳,
故答案为:HCl(盐酸);Ca(OH)2(石灰乳);CaCl2?6H2O;CaCl2;AgCl.
本题解析:
本题难度:一般
3、简答题 常见的无机物之间有如图所示的转化关系,已知,A、B、C、D、G含有同一种元素,E是通常情况下密度最小的气体,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,B具有氧化性,能将SO2氧化为F(H2SO4),F与A反应生成E和G.相关物质的颜色如下表:
| 物质 | 纯A(单质) | B溶液 | C固体 | D固体 | G溶液
颜色
银白色
黄色
红褐色
红棕色
浅绿色
|
依据以上信息填空:
(1)写出物质的化学式:D______,E______.
(2)G生成C的过程所出现的现象为______,反应的化学方程式为______.
(3)写出下列转化的离子方程式:
F→E______;
B→F______.

参考答案:E是通常情况下密度最小的气体,E是氢气,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,说明B中有氯元素,B溶液显黄色,又知B具有氧化性,能将SO2氧化为硫酸,则B是FeCl3,C固体是红褐色,为Fe(OH)3,结合转化关系,红棕色固体D为Fe2O3,则A、B、C、D、G含有同种元素为铁元素,可推知A为Fe,硫酸与铁反应生成E、G,G溶液为浅绿色,所以G为FeSO4,
(1)由上述分析可知,D为Fe2O3FeSO4,E是H2,
故答案为:Fe2O3:H2;
(2)G为硫酸亚铁,加入碱生成白色的氢氧化亚铁,氢氧化亚铁不稳定,易与氧气反应生成红褐色的氢氧化铁沉淀,有关反应方程式为:FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色;FeSO4+NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)F→E的离子方程式为:Fe+H+=Fe2++H2↑,
B→F的离子方程式为:2Fe3++Fe═3Fe2+,
故答案为:Fe+H+=Fe2++H2↑;2Fe3++Fe═3Fe2+.
本题解析:
本题难度:一般
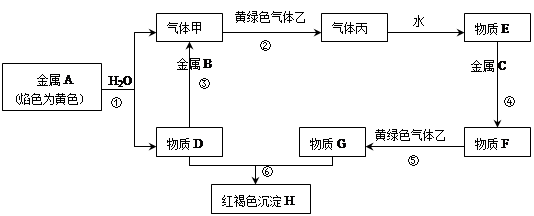
4、填空题 现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。
请回答下列问题:
(1)写出下列物质的化学式:B?、丙?、乙?。
(2)写出下列反应的化学方程式:
反应①?;
反应⑤?;
反应⑥??。
参考答案:(1) Al? HCl? Cl2[
(2) ① 2Na+2H2O=2NaOH+H2↑
⑤2FeCl2+Cl2=2FeCl3?
⑥3NaOH+FeCl3=Fe(OH)3↓+3NaCl
本题解析:由金属A焰色反应为黄色知A为钠,则甲为氢气,D为氢氧化钠,B为铝,乙为黄绿色气体,则乙为氯气,丙为氯化氢,E为稀盐酸,H为黄褐色沉淀氢氧化铁,所以C为铁,F为氯化亚铁,G为氯化铁。所以,(1)B:Al、乙:Cl2、丙:HCl;
(2)反应①的方程式:2Na+2H2O=2NaOH+H2↑
反应⑤方程式:2FeCl2+Cl2=2FeCl3
反应⑥方程式:3NaOH+FeCl3=Fe(OH)3↓+3NaCl
本题难度:一般
5、填空题 (15分)
常温下D、E、F、I、J为气体,H、I、J都为氧化物;C的焰色反应为黄色;M为红褐色的固体,由G分解得到的H、I、J三者的物质的量相等.下图表示各物质之间的转化关系.

试回答下列问题:
(1)写出L的化学式?.
(2)基于反应①原理的化学工业称为?.
写出该反应①的离子方程式?.
(3)反应②的现象是?.
(4)写出H与Al在高温下反应的化学方程式?.
(5)写出反应③的化学方程式? ?. ?.
参考答案:
(1)Fe(OH)2(2分)
(2)氯碱工 业(2分)? 2Cl-+2H2O 业(2分)? 2Cl-+2H2O 2OH-+H2↑+Cl2↑(3分) 2OH-+H2↑+Cl2↑(3分)
(3)白色→灰绿色→红褐色(2分)
(4)3FeO + 2Al Al2O3 + 3Fe (3分) Al2O3 + 3Fe (3分)
(5)FeC2O4 FeO + CO↑+CO2↑(3分) FeO + CO↑+CO2↑(3分)
本题解析:略
本题难度:一般
|