微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有10个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:
A ??, C?,D?,E?
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:??。
(3)写出A、B两元素的最高价氧化 物的水化物之间的相互反应的化学方程式:??。
物的水化物之间的相互反应的化学方程式:??。
(4)比较C、D的最高价氧化物的水化物的酸性:(用化学式表示)
?
参考答案:
本题解析:略
本题难度:一般
2、推断题 A、B、C、D、E、F六种的转化关系如右图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应。X、Y属于同一周期,且核电荷数相差4。
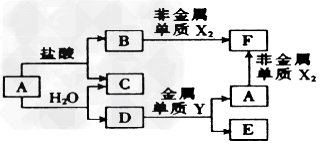
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型:__________;D的化学式为___________;元素X、Y的原子半径大小顺序是____________(用元素符号表示)。
(2)E与NaOH溶液反应的离子方程式为____________。
(3)反应A+H2O→C+D的化学方程式为______________。
(4)F能促进H2O的电离,其原因是__________(用离子方程式表示)。
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH=_______________。
参考答案:(1)共价键;?Fe3O4;Al>Cl?
(2)Al2O3+2OH-=2AlO2-+H2O?
(3)Fe?+?4H2O(g)?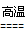 Fe3O4?+?4H2?
Fe3O4?+?4H2?
(4)?3Fe3+?+?3H2O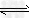 Fe(OH)3?+?3H+?
Fe(OH)3?+?3H+?
(5)?3
本题解析:
本题难度:一般
3、填空题 已知有下列物质相互转化
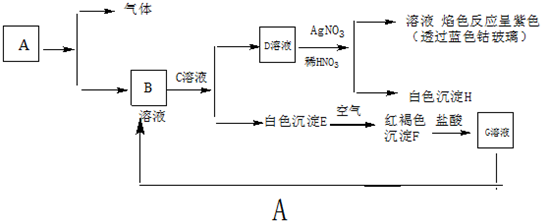
提示:A与盐酸反应生成气体和B溶液
试回答:(1)写出B的化学式______;D的化学式______
(2)写出由E转变成F的化学方程式______
(3)向G溶液中加入A的有关离子方程式______.
参考答案:(1)白色沉淀E在空气中转变为红褐色沉淀F,可推断出白色沉淀为E为Fe(OH)2,红褐色沉淀F为Fe(OH)3,G溶液为FeCl3,故B中含有Fe2+;由透过蓝色钴玻璃观察焰色反应为紫色,知道D溶液中含有K元素,又有D与AgNO3生成白色沉淀H,知道H为AgCl;故D为KCl,所以B中溶液中还含有Cl-.故B为FeCl2,故D为KCl,答案:FeCl2;KCl;
(2)Fe(OH)2在空气中与O2反应转变为Fe(OH)3的反应为氧化还原反应.1mol铁失去一个电子,化合价升高,氧元素得到电子,化合价由0价降低为-2价.故1molO2得到4mol电子;依据元素守恒以及得失电子守恒知该反应方程式为:4Fe(OH)2+2H2O+O2=4Fe(OH)3,答案:4Fe(OH)2+2H2O+O2=4Fe(OH)3;
(3)依据题给条件,A与盐酸反应生成气体和B溶液,以及G转变为B,即FeCl3转变为FeCl2可以知道A为Fe.依据电荷守恒和氧化还原反应“两头价态中间转”可以配平该反应,
答案:2Fe3++Fe=3Fe2+.
本题解析:
本题难度:简单
4、推断题 工业上用铝土矿(主要成分为Al2O3,还含有Fe2O3、SiO2)提取氧化铝做冶炼铝的原料,提取的操作过程如下: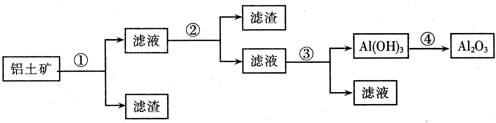
(可供选择的试剂:稀盐酸、NaOH溶液、稀氨水,CO2等)
请写出你所设计的方案中以下各步反应涉及的化学方程式.
①____________________________________________________________________
②______________________ ______________________________________________
④___________________________________________
参考答案:① (2分)
(2分)
 (2分)
(2分)
②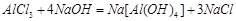 (2分)
(2分)
 (2分)
(2分)
(若将第一个反应分成两步写也可: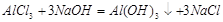 ,
,
 , 每写对1个得1分。 )
, 每写对1个得1分。 )
③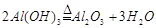 (2分,不写加热条件扣1分)
(2分,不写加热条件扣1分)
本题解析:铝土矿的主要成分有Al2O3、Fe2O3、SiO2。步骤①所加试剂为稀盐酸,发生反应的化学方程式为:Al2O3+6HCl=2AlCl3+3H2 、Fe2O3+6HCl=2FeCl3+3H2O 。经步骤①后,所得的滤渣为SiO2,滤液中溶质为AlCl3、FeCl3。因此步骤②往滤液中加入的溶液应为NaOH溶液,发生反应的化学方程式为AlCl3+4NaOH=NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3
、Fe2O3+6HCl=2FeCl3+3H2O 。经步骤①后,所得的滤渣为SiO2,滤液中溶质为AlCl3、FeCl3。因此步骤②往滤液中加入的溶液应为NaOH溶液,发生反应的化学方程式为AlCl3+4NaOH=NaAlO2+2H2O、FeCl3+3NaOH=Fe(OH)3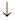 +3NaCl。经步骤②后所得滤渣为Fe(OH)3,滤液的主要成分为NaAlO2。因此步骤③中加入的应为CO2。步骤④仅为金属氢氧化物的加热,因此其化学方程式为:2AlOH3
+3NaCl。经步骤②后所得滤渣为Fe(OH)3,滤液的主要成分为NaAlO2。因此步骤③中加入的应为CO2。步骤④仅为金属氢氧化物的加热,因此其化学方程式为:2AlOH3 Al2O3+3H2O。
Al2O3+3H2O。
点评:以推断题的形式,考查金属及其化合物的相关性质。对此类题型的考查通常用结合铝及其化合物。解题的关键在于熟练掌握“铝三角”的相关反应。
本题难度:一般
5、填空题 有关物质存在如图所示转化关系(部分产物已略去)。
已知A、B是均能使澄清石灰水变浑浊的气体。M为无色液体,常用作有机溶剂,其结构与A相似且为非极性分子。C、E均难溶于水且E难溶于酸。
(1)单质N在X中燃烧可形成一种具有磁性的黑色物质,则构成N的元素在周期表中的位置为?。
(2)M的电子式为?,Y的化学式为?。
(3)①写出离子方程式:A→C?
②检验O中阴离子的方法为?
(4)将M滴入O溶液中,观察到溶液变浑浊,请推断反应的化学方程式:?
?。
参考答案:(1)第四周期? Ⅷ族?(2)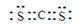 Ba(OH)2
Ba(OH)2
(3)①CO2+Ba2++2OH-=BaCO3↓+H2O?
②取少量O溶液,先加HCl溶液无现象,再加BaCl2溶液,有白色沉淀
(4)2H2O+CS2+2Fe2(SO4)3=2S↓+CO2↑+4FeSO4+2H2SO4
本题解析:略
本题难度:一般