| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《常见的化学电源》考点特训(2017年冲刺版)(二)
 参考答案:A、甲池是甲醇燃料电池,是原电池的工作原理,化学能转化为电能,乙池是电解池,是电能转化为化学能,故A错误; 本题解析: 本题难度:一般 2、选择题 实验室用铅蓄电池作电源电解饱和食盐水制取氯气,已知铅蓄电池放电时发生如下反应: |
参考答案:D
本题解析:电解食盐水制取氯气发生的电极反应式是2Cl--2e-=Cl2↑,若制得0.10mol氯气,则失去0.20mol的电子,根据得失电子守恒,在原电池中转移电子的物质的量也是0.20mol,根据PbO2+4H++SO42-+2e-= PbSO4+2H2O可知消耗氢离子的物质的量是0.40mol,则消耗硫酸的物质的量至少是0.20mol,答案选D。
考点:考查电化学反应的计算
本题难度:一般
3、选择题 最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH).下列说法正确的是( )
A.该电池Zn为负极,ZnO为正极,MnO2为催化剂
B.该电池的负极反应为:MnO2+e-+H2O=MnO(OH)+OH-
C.导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn
D.电池工作时水分子和OH-都能通过薄层纸片
参考答案:A、从电池反应可知,锌失去电子被氧化,所以是负极,MnO2为正极,故A错误;
B、该电池反应中锌失去电子被氧化,所以是负极,电极反应为Zn-2e-+2OH-=ZnO+H2O,故B错误;
C、导电时外电路电子由负极经外电路流向正极,即Zn流向MnO2,内电路是离子的定向移动形成电流,故C错误;
D、“软电池”采用薄层纸片作为载体和传导体,电池工作时水分子和OH-都能通过薄层纸片,故D正确.
故选D.
本题解析:
本题难度:简单
4、选择题 (10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+ 8NH3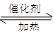 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g)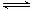 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
2NO(g)+O2(g)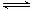 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
则反应NO2(g)+SO2(g)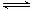 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(3)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
当电池放电时,正极电极反应式为 。
参考答案:(共10分)
(1)6.72(3分)
(2)- 41.8(3分)
(3)Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-(4分)
本题解析:
⑴NO2在标准状况下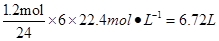
⑵①2SO2(g)+O2(g)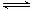 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
②2NO(g)+O2(g)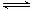 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
(①
本题难度:困难
5、选择题 新型LiFePO4可充电锂离子动力电池以其独特的优势成为绿色能源的新宠.已知该电池放电时,正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+.下列说法中正确的是( )
A.充电时动力电池上标注“+”的电极应与外接电源的正极相连
B.充电时电池反应为FePO4+Li++e-=LiFePO4
C.放电时电池内部Li+向负极移动
D.放电时,在正极上Li+得电子被还原
参考答案:A.充电时动力电池上标注“+”的电极应与外接电源的正极相连,发生氧化反应:LiFePO4-e-=FePO4+Li+,故A正确;
B.放电时电池反应为FePO4+Li=LiFePO4,则充电时电池反应为LiFePO4=FePO4+Li,故B错误;
C.放电时电池内部Li+向正极移动,故C错误;
D.放电时,在正极上FePO4得电子被还原,故D错误.
故选A.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《无机综合与.. | |