微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)用铜和硫酸铜、银和硝酸银溶液设计一个原电池,电池的负极是______,正极电极反应式是:______.
(2)已知某电池的负极反应为:Cd-2e-+2OH-═Cd(OH)2,正极反应为:NiO(OH)2+2e-+H2O═Ni(OH)2+2OH-.则该电池的电解质溶液可能为______,总反应的化学方程式______.
(3)用惰性电极电解稀硫酸、NaOH溶液、NaCl溶液、CuSO4溶液,试写出:电解稀硫酸的阳极反应式______,电解NaOH溶液的阴极反应式______,电解NaCl溶液的总反应化学方程式______,电解CuSO4溶液总反应的离子方程式______.
参考答案:(1)铜比银活泼,在铜、银原电池中铜为负极,正极发生还原反应,阴离子得到电子被还原,电极方程式为2Ag-2e-═2Ag+,
故答案为:铜;2Ag-2e-═2Ag+;
(2)正负极电极方程式相加可得总反应式为Cd+NiO(OH)2+H2O═Cd(OH)2+Ni(OH)2,Cd(OH)2和Ni(OH)2只能存在碱性溶液中,则应为KOH或NaOH,
故答案为:KOH;Cd+NiO(OH)2+H2O═Cd(OH)2+Ni(OH)2;
(3)电解硫酸溶液,氧气发生氧化反应生成氧气,电极方程式为4OH--4e-═2H2O+O2↑;电解氢氧化钠溶液,阴极发生还原反应生成氢气,电极方程式为2H++2e-═H2↑;电解NaCl溶液可得到氯气、氢气和氢氧化钠,电解总方程式为2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑,电解硫酸铜溶液生成铜、氧气和硫酸,总方程式为 2Cu2++2H2O电解. 2Cu+4H++O2↑,
故答案为:4OH--4e-═2H2O+O2↑;2H++2e-═H2↑;2NaCl+2H2O电解.2NaOH+H2↑+Cl2↑;2Cu2++2H2O电解. 2Cu+4H++O2↑.
本题解析:
本题难度:简单
2、选择题 ?依据氧化还原反应: 2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:
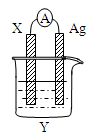
(1)电极X的材料是______;电解质溶液Y是________;
(2)银电极为电池的____极,发生的电极反应式为_______? ___;X电极上发生的电极反应为_____________________;(填反应类型)
(3)外电路中的电子是从_______电极流向________电极。
(4)当有1.6g铜溶解时,银棒增重_________________。
参考答案:(1)Cu;AgNO3
(2)正极;?Ag++e-=Ag;?氧化反应
(3)X(或Cu);Ag
(4)5.4g
本题解析:在原电池的总反应方程式中,化合价升高的做负极,所以在这个原电池中,铜做负极,而负极的活泼性大于正极,因此,正极我们可以选择银或者碳棒。总反应式中有银离子参与反应,所以在电解质溶液中会含有银离子。因此电解质溶液,我们可以选择硝酸银。正极发生的是氧化反应,电极反应式为?Ag++e-=Ag。电子的流动方向是负极指向正极,所以应是铜流向银。1.6克的铜相当于0.025摩尔的铜。即失去0.025乘以2等于0.05摩尔的电子。而据得失电子总数相等可知,银离子应得到0.05摩尔的电子由?Ag++e-=Ag可知会得到0.05摩尔的银则银的质量为0.05乘以108等于5.4克。
本题难度:一般
3、填空题 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)图中通过负载的电子流动方向______(填“向左”或“向右)
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式正极:______负极:______总反应:______
(3)为了获得氢气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和H2O反应生成H2和CO的化学方程式:______
(4)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为______,电池总离子反应方程式为______.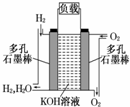
参考答案:(1)根据原电池工作原理,负极上失电子,电子从负极沿外电路流向正极,所以通过负载的电子流动方向是向右.
故答案为:向右;
(2)正极上氧气得电子和水生成氢氧根离子,发生还原反应,所以电极反应式为2H2O+O2+4e-═4OH-;负极上失电子和氢氧根离子反应生成水,所以电极反应式为2H2+4OH--4e-═4H2O;两极上的电极反应式相加得总反应方程式,所以总反应方程式为2H2+O2═2H2O.
故答案为:2H2O+O2+4e-═4OH-;2H2+4OH--4e-═4H2O;2H2+O2═2H2O;
(3)该反应中反应物是丙烷和H2O,产物是H2和CO,反应条件是高温、催化剂,所以方程式为
C3H8+3H2O?催化剂?.高温3CO+7H2.故答案为:C3H8+3H2O?催化剂?.高温3CO+7H2;
(4)负极上是燃料失电子,正极上是氧气得电子,所以负极上甲烷反应生成二氧化碳,二氧化碳是酸性氧化物,能和电解质溶液KOH反应生成盐和水,所以正极上的电极反应式为CH4+10OH--8e-═CO32-+7H2O;正极上氧气得电子和水生成氢氧根离子;正负极上的电极反应式相加得总反应方程式,所以总反应方程式为CH4+2O2+2OH-═CO32-+3H2O.
故答案为:CH4+10OH--8e-═CO32-+7H2O;CH4+2O2+2OH-═CO32-+3H2O.
本题解析:
本题难度:一般
4、填空题 某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
 ?
?
①图中X溶液是?;
②石墨电极上发生的电极反应式为?;
③原电池工作时,盐桥中的?(填“K+”或“Cl-”)不断进入X溶液中。
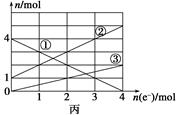
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是?极;?②图丙中的②线是?的变化。
③当电子转移为2 mol时,向乙烧杯中加入??L 5 mol·L-1 NaOH溶液才能使Cu2+沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应式是?。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是?。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为?。
参考答案:(1) ①FeCl3、FeCl2?②Fe3++e-=Fe2+③K+? (2)①负
②Fe2+(或者FeCl2)③2.8? (3)①Fe+8OH--6e-=FeO42-+4H2O
②2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O
本题解析:(1)①该反应应该是Cu+2FeCl3=CuCl2+2FeCl2,其中铜是还原剂作负极,正极是氯化铁得到电子被还原为氯化亚铁,所以装置中X应该是FeCl3、FeCl2。
②石墨是正极,铁离子得到电子,电极上发生的电极反应式为Fe3++e-=Fe2+。
③原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应,因此该原电池工作时,盐桥中的K+不断进入X溶液中。
(2)①根据丙图可知溶液中有三种金属阳离子,而根据X的成分可知X中只有两种金属阳离子,说明在电解过程中还有Cu2+生成,因此Cu做阳极,石墨做阴极,所以M为负极,N为正极。
②根据转移电子的物质的量和金属阳离子的物质的量的变化,可知①为Fe3+,②为Fe2+,③为Cu2+。③当电子转移为2mol时,溶液中有Fe3+ 2mol,Fe2+ 3mol,Cu2+为1mol,所以需要加入NaOH溶液14mol,因此NaOH溶液等体积为14mol÷5mol/L=2.8L。
(3)①电解时阳极发生氧化反应,电极反应方程式为Fe+8OH--6e-═FeO42-+4H2O;
②NaClO氧化Fe(OH)3的反应方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O。
本题难度:简单
5、选择题 由铜、锌和稀硫酸组成的原电池工作时,电解质溶液的pH怎样变化?
[? ]
A.不变
B.先变小后变大
C.逐渐变大
D.逐渐变小
参考答案:C
本题解析:
本题难度:简单