微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,某同学拟对其原理及条件进行分析:
(1)该同学准备了下列实验用品:20% NaCl溶液、蒸馏水、酚酞试液、KSCN溶液、新制氯水、纯铁丝、碳棒、U形管、导线等;请你帮他设计一个实验方案来验证钢铁吸氧腐蚀的电极产物,简述操作过程并写出溶液中有关反应的离子方程式。
(2)将一铜棒、碳棒用导线连接后,插入内盛20%氯化钠溶液的U形管中,请根据此装置在下列两项中择一
回答:
①若不是原电池,请说明原因: (如果回答此题,下面的②不用回答)。
②若是原电池,现要求利用此装置(电极材料、溶液浓度均不变),采取适当的措施来提高电池的放电效率,该操作可以是: ?。
(3)目前我国许多大型铜质文物露天放置腐蚀严重,在不影响观瞻效果的条件下,除用加保护层法保护外,请你再提出一项简单而有效的保护方法并简述其保护原理:?。
参考答案:(1)用导线连接纯铁丝和碳棒后插入盛有20% NaCl溶液的U形管中,放置数分钟,向插入纯铁丝的一端滴入1~2滴KSCN溶液未显色,再滴入氯水显(血)红色,证明负极有Fe2+生成,相关离子方程式为:2Fe2++Cl2=2Fe3++2Cl-;Fe3++3SCN-=Fe(SCN)3。向插入碳棒的一端滴入酚酞溶液,溶液显红色,证明有OH-生成
(2)②向插入碳棒的溶液中通入氧气或空气
(3)将铁块(或锌块)连接文物底座并埋入地下,定期更换;原理是:使文物成为原电池的正极(或使铜文物用导线连接直流电源的负极,正极用导线连接埋入地下的导体;原理是:使文物成为电解池的阴极)
本题解析:(1)为加速腐蚀,应选用20% NaCl溶液为电解质溶液,以纯铁丝和碳棒作两极,分别针对两极产物Fe2+和OH-进行检验。(2)具备构成原电池的基本条件,所以是原电池,在正极上发生还原反应的是空气中的O2,要加快反应速率,可增大O2浓度。(3)在众多限制下,可考虑电化学保护法。
本题难度:一般
2、选择题 下列有关说法正确的是
A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H> 0
B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极
C.常温下,0.1mol·L-1 CH3COOH溶液pH=1
D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小
参考答案:A
本题解析:A.反应CO2(g)+C(s)=2CO(g)△H> 0,△S> 0故在高温下可自发进行,正确;B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极时会发生反应产生二价铁离子,错误;C.CH3COOH是弱酸不能完全电离,常温下,0.1mol·L-1 CH3COOH溶液pH大于1,错误;D.Ksp(AgCl) 只与温度有关,温度不变其值也不会改变,错误;正确答案为A。
本题难度:一般
3、选择题 下列说法中正确的是
A.在原电池中,物质在负极发生氧化反应
B.在原电池中,电子由正极流向负极
C.在电解池中,物质在阴极发生氧化反应
D.在电解池中,与电源正极相连的电极是阴极
参考答案:A
本题解析:在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应,所以选项A正确,其余选项都是错误的,答案选A。
考点:考查原电池的有关判断。
点评:原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
本题难度:一般
4、选择题 瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(图甲)的传感器煤矿巷道中的甲烷达到一定浓度时可以显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述不正确的是
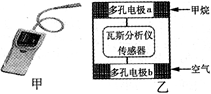
A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B.电极b是正极,O2-由电极b流向电极a
C.电极a的反应式为:CH4 + 4O2- - 8e- = CO2 + 2H2O
D.当固体电解质中有1 molO2- 通过时,电子转移2 mol
参考答案:A
本题解析:A、电子不能在电池内电路流动,只能在外电路中流动,故A错误;B、电极b氧气得电子,生成O2-,而电极a需要O2作为反应物,故O2-由正极(电极b)流向负极(电极a),故B正确;C、甲烷所在电极a为负极,电极反应为:CH4+4O2--8e-=CO2+2H2O,故C正确;D、1mol?O2得4mol电子生成2molO2-,故当固体电解质中有1mol?O2-通过时,电子转移2mol,故D正确;故选A。
本题难度:一般
5、简答题 (1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O=4Al(OH)3,负极为:______,负极发生:______反应(填“氧化”或“还原”);正极为铂网,______(填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向______(填“正极”或“负极”).
若电路中转移3mol电子,则负极材料质量减少______克
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2=2H2O.酸式氢燃料电池的电解质是酸、其负极反应为:2H2-4e-=4H+,则正极反应为______;
碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-=4OH-,则负极反应为:______.
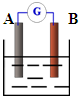
(3)如右图:若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为______极(填正或负),写出电极反应式:正极______负极______.
参考答案:(1)根据反应方程式知,负极是Al,负极失电子发生氧化反应;正极为铂网,电子从负极经外电路到正极,电流正好相反,从正极经外电路到负极;正极上聚集大量电子,根据异性相吸,所以钠离子移向正极.
4A1+3O2+6H2O=4A1(OH)3转移电子
4×27g12mol
27g 3mol
故答案为:Al;氧化;电流;正极;27.
(2)酸式氢燃料电池的电解质是酸、
电池总反应式均可表示为:2H2+O2=2H2O①
其负极反应为:2H2-4e-=4H+②,
则正极反应为 ①-②,即O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的电解质是碱,
其正极反应表示为:O2+2H2O+4e-=4OH-③,
则负极反应为①-③,即2H2-4e-+4OH-=4H2O
故答案为:O2+4e-+4H+=2H2O;2H2-4e-+4OH-=4H2O.
(3)根据正负极材料的活泼性知,铁片作负极,铜片作正极;正极上 Fe3+得电子生成Fe2+,所以电极反应式为
2Fe3++2e-=2 Fe2+;负极上铁失电子生成Fe2+,所以电极反应式为Fe-2e-=Fe2+.
故答案为:正;2Fe3++2e-=2 Fe2+;Fe-2e-=Fe2+.
本题解析:
本题难度:一般