微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是
A.BeCl2分子中各原子最外层均已满足8电子稳定结构
B.第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素一定在第ⅢA族
C.构成单质分子的粒子间一定存在化学键
D.含有离子键的化合物一定是离子化合物
参考答案:D
本题解析:BeCl2分子中Be没有满足8电子稳定结构,第ⅡA族的某元素原子序数为x,则原子序数为x+1的元素在第ⅢA族、网ⅢB族。构成单质稀有气体分子的粒子间没有化学键。
本题难度:一般
2、选择题 下列物质性质变化规律与化学键无关的是( )
①HF、HCl、HBr、HI的热稳定性依次减弱?②NH3易液化
③F2、C12、Br2、I2的熔、沸点逐渐升高?④H2S的熔沸点小于H2O的熔、沸点
⑤NaF、NaCl、NaBr、NaI的熔点依次减低.
A.①③④
B.③④
C.②③④
D.全部
参考答案:①影响HF、HCl、HBr、HI稳定性的因素是化学键键能的大小,与化学键有关,故①不选;
②NH3易液化是由于含有氢键的原因,不属于化学键,故②选;
③F2、C12、Br2、I2属于分子晶体,影响熔沸点高低的因素是分子间作用力的大小,与化学键无关,故③选;
④H2S属于分子晶体,影响沸点高低的因素是分子间作用力,H2O含有氢键,则熔沸点比H2S高,与化学键无关,故④选;
⑤NaF、NaCl、NaBr、NaI属于离子晶体,影响熔点高低的因素是化学键的强弱,故⑤不选.
故选C.
本题解析:
本题难度:简单
3、实验题 50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在图示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
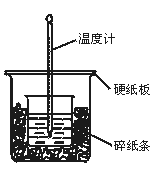
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50 mol·L-1盐酸跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”“不相等”),所求中和热 (填“相等”“不相等”),简述理由: 。
参考答案:(1)环形玻璃搅拌棒(2)减少实验过程中的热量损失(3)减小
(4) 不等 相等 因为中和热是指酸和碱发生中和反应生成1molH2O所放出的热量,
与酸碱的用量无关
本题解析:中和热的测定过程中使用的酸和碱的量不同,反应放出的热量不同,但是中和热是指生成1mol水时放出的热量,所以中和热相同。
考点:中和热的测定。
本题难度:一般
4、选择题 已知反应:H2S(g)+aO2(g)=X+cH2O(l) ΔH,若ΔH表示该反应的标准燃烧热,则X为
A.S(s)
B.SO2(g)
C.SO3(g)
D.SO3(l)