微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (11分)化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
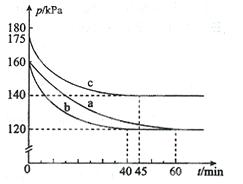
①列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为 。
参考答案:(1)AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1
(2)①
②bca(2分) b、加人催化剂。反应速率加快,但平衡点没有改变c、 温度升高。反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)
③α=2(1-p/p0)
本题解析:(1)根据题给信息,室温时AX3为液态,AX5为固态。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为AX3(l)+X2(g) = AX5(s) ΔH=-123.8KJ·mol-1;(2)①根据题给信息和图像知,开始时no =" 0.4" mol,总压强为160 kPa,平衡时总压强为120 kPa,根据阿伏伽德罗定律则平衡时气体的总物质的量为0.30mol,利用三行式分析,设转化的AX5的物质的量为x
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始量(mol) 0.20 0.20 0
平衡量(mol) 0.20 -x 0.20 -x x
(0.20-x)+(0.20-x)+x = 0.30,解得x = 0.10
则v(AX5)= ;
;
②从图中观察平衡的时间(tb<tc<ta),判断反应速率的快慢为b>c>a;b组的反应速率加快,但平衡点没有改变说明是加人了催化剂;c组的反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大)说明是温度升高。③用三行式分析:
AX3(g) + X2(g)  AX5(g)
AX5(g)
起始量(mol) 0.20 0.20 0
变化量(mol) 0.20α 0.20α 0.20α
平衡量(mol) 0.20 -0.20α 0.20 -0.20α 0.20α
据题意有p0/p=0.4mol/(0.4—0.2?)mol,化简得α=2(1-p/p0)。
考点:考查热化学方程式的书写,化学反应速率的计算,化学平衡移动原理的应用,转化率的计算等。
本题难度:困难
2、选择题 下列事实与氢键有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.水加热到很高的温度都难以分解
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.水结成冰体积膨胀
参考答案:D
本题解析:A、它们都是通过共价键结合,元素的非金属性越强,其氢化物就越稳定,由于非金属性F>Cl>Br>I,所以稳定性HF、HCl、HBr、HI的热稳定性依次减弱。但是这与氢键无关。错误。B、水加热到很高的温度都难以分解,是因为在水分子内的H—O键的键能大,与氢键无关。错误。C、CH4、SiH4、GeH4、SnH4都是由分子构成的物质。结构相似。物质的相对分子质量越大,分子间作用力就越大,克服分子间作用力使物质熔化消耗的能量就越高。即熔点随相对分子质量增大而升高。但是与氢键无关。错误。D、水结成冰,在物质内分子的排列由无序变为有序,在水分子之间存在氢键。分子之间的间隔增大,体积膨胀。也正是这种作用力,增加例如水中溶解氧气量。使水中的植物和动物都可以存活。正确。
考查:物质的性质与氢键的关系的知识。
本题难度:一般
3、填空题 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g)。其化学平衡常数K和温度T的关系如下表:
T℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
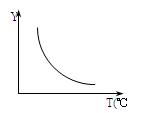
(1)该反应正向为ΔH 0;若该反应符合下图所示的关系,则在图中,Y轴是指 。
(2)能判断该反应达到化学平衡状态的依据是 (多选扣分)。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v (H2)正=v (H2O)逆 d.c(CO2)=c(CO)
(3)某温度下,平衡浓度符合下式: 0.9·c(CO2)·c(H2)=c(CO)·c(H2O),由此可以判断此时的温度为 ℃。其它条件不变,升高温度,原化学平衡向 反应方向移动(填“正”或“逆” ),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
),容器内混合气体的密度 (填“增大”、“减小”或“不变”),气体平均相对分子质量 (填“增大”、“减小”或“不变”)。
(4)若在一密闭容器中,将一定量的CO与H2O混合加热到830℃下达到平衡。若反应开始时CO与H2O的浓度分别为0.200 mol/L和0.100 mol/L,平衡时CO的转化率 。
参考答案:(1)>(1分);CO2或H2的百分含量(1分)(其它合理答案也给分)
(2)b、c (漏选、多选、错选均不得分,2分)
(3)800℃; 正; 不变; 不变(各1分)
(4)33.3%(2分)
本题解析:略
本题难度:一般
4、选择题 某溶液中大量存在5种离子:NO3-、SO42-、Fe3+、H+、M其物质的量之比为n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,则M可能为
A.Fe2+
B.Mg2+
C.Cl-
D.Ba2+
参考答案:B
本题解析:分析:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,由电荷守恒可知,M为阳离子,结合离子的共存来解答.
解答:n(NO3-):n(SO42-):n(Fe3+):n(H+):n(M)=2:3:1:3:1,
2×1+3×2>1×3+3×1,由电荷守恒可知,M为阳离子,设电荷数为x,则
2×1+3×2=1×3+3×1+x×1,解得x=2,
又NO3-、Fe2+、H+发生氧化还原反应,则不能共存,则M为Mg2+,
故选B.
点评:本题考查离子的共存,注意利用电荷守恒分析M是解答本题的关键,离子之间的氧化还原反应为解答的难点,题目难度中等.
本题难度:简单
5、填空题 (4分)已知1mol H2燃烧生成液态水放出热量为285.8kJ,C2H4、C2H6各1mol分别燃烧生成液态水和CO2,放出热量分别为1409.5kJ、1558kJ。试写出C2H4生成C2H6的热化学方程式 。

参考答案:C2H4(g)+H2(g)=C2H6(g) △H=-137.3kJ/mol
本题解析:根据已知信息可知,氢气、乙烯和乙烷燃烧的热化学方程式分别是①H2(g)+1/2O2(g)=H2O(l) ΔH=-285.8kJ/mol;②C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1409.5kJ/mol;③C2H6(g)+7/2O2(g)=2CO2(g)+3H2O(l) ΔH=-1558kJ/mol。所以根据盖斯定律可知,①+②-③即得到C2H4(g)+H2(g)=C2H6(g),所以该反应的反应热△H=-285.8kJ/mol-1409.5kJ/mol+1558kJ/mol=-137.3kJ/mol。
考点:考查盖斯定律的应用和反应热的计算
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力和应试能力,提高学生的学习效率。该题的关键是准确写出有关反应的热化学方程式,然后根据盖斯定律直接列式计算即可。
本题难度:一般