微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为?。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为?。
(3)下列措施能增强84消毒液杀菌能力的是?。
A.加入适量醋酸? B.加入适量亚硫酸? C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是?。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为?。
参考答案:(7分)
(1)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (1分)
2NaOH + H2↑+ Cl2↑ (1分)
(2)Cl2 + 2OH-= Cl-+ ClO-+ H2O?(1分)
(3)A?(1分)
(4)B C(2分,少选得1分,多选、错选不得分)
(5)ClO-+2e-+ H2O→Cl-+2OH-(2分)
本题解析:
(1)工业生产通过电解饱和食盐水化学方程式为:2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
(2)氯气与氢氧化钠溶液反应离子方程式:Cl2 + 2OH-= Cl-+ ClO-+ H2O?
(3)存在ClO-+ H2O HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
(4)A、溶液存在电荷守恒:c(Na+) + c(H+) = c(OH-) + c(Cl-)+ c(ClO-),错误;B、由电荷守恒,和溶液呈中性:c(H+) = c(OH-),知c(Na+) = c(ClO-) + c(Cl-),正确;C、根据氯发生歧化反应物料守恒知:c(ClO-) + c(HClO) =c(Cl-),结合c(Na+) = c(ClO-) + c(Cl-),得c(Na+) = 2c(ClO-) + c(HClO),正确。
(5)ClO-的强氧化性会氧化铁,所以正极反应为:ClO-+2e-+ H2O→Cl-+2OH-。
本题难度:一般
2、选择题 把HCl气体通入到饱和食盐水中会发生的变化是
A.溶液酸性增强
B.产生少量氯气和氢气
C.有晶体析出
D.产生微量氧气
参考答案:A
本题解析:HCl极易溶于水,通入到饱和食盐水中HCl溶解形成盐酸,溶液的酸性增强。但与饱和食盐水不反应。答案选A。
本题难度:一般
3、选择题 下列物质能通过化合反应直接制得的是( )
①FeCl2?②H2SO4?③NH4Cl?④NO.
A.只有①②③
B.只有②③④
C.只有①③④
D.全部
参考答案:①因铁在氯气中燃烧生产氯化铁,发生化合反应,故①正确;
②因三氧化硫与水化合生成硫酸,发生化合反应,故②正确;
③因氨气和氯化氢反应生成氯化铵,发生化合反应,故③正确;
④因氮气和氧气在放电条件下生成一氧化氮,发生化合反应,故④正确,
故选D.
本题解析:
本题难度:一般
4、填空题 组同学发现84消毒液与洁厕剂(主要成分为盐酸)室温下混和有Cl2生成,于是尝试在实验室利用该反应原理制取Cl2。
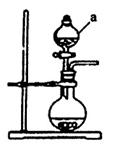
(1)若用次氯酸钙、浓盐酸为原料,利用下图装置制取Cl2。装置中仪器a的名称为 ?。甲同学想证明Cl2溶于水有酸性物质生成,将发生装置产生的气体直接通入适量水中,并加入NaHCO3粉末,有无色气泡产生。乙同学认为不合理,理由是?。又知:室温下H2CO3的电离常数K1=4.2×10-7,K2=5.6×10-11,则pH为8.0的NaHCO3溶液中[CO32-]:[HCO3-]=??。
(2)经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。设计如下装置制备无水FeCl3。
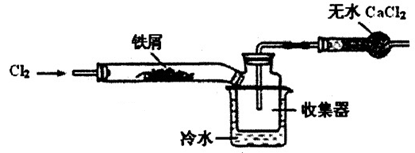
①下列操作步骤的正确排序为??(填字母)。
A.体系冷却后,停止通入Cl2
B.通入干燥的Cl2赶尽装置中的空气
C.在铁屑下方加热至反应完成
D.用干燥的H2赶尽Cl2
 NaClO3+3H2
NaClO3+3H2 ,
, +Cl2
+Cl2 +2NaCl+2H2O。
+2NaCl+2H2O。