微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在平衡体系2NO+O2 ?2NO2中通入18O组成的氧气,重新达到平衡后,则18O
?2NO2中通入18O组成的氧气,重新达到平衡后,则18O
A.只存在于O2中
B.只存在于NO2中
C.只存在于O2和NO2中
D.存在于NO、O2、NO2
参考答案:D
本题解析:2NO+O2 ?2NO2这个反应是可逆反应,在18O2投入后,在正逆反应的过程中,使得18O存在于NO、O2、NO2中。
?2NO2这个反应是可逆反应,在18O2投入后,在正逆反应的过程中,使得18O存在于NO、O2、NO2中。
本题难度:简单
2、选择题 将一定质量的Ag2SO4固体置于容积不变的密闭容器中(加入少量V2O5),在某温度时发生下列反应:Ag2SO4(s) Ag2O(s)+SO3(g),2SO3(g)
Ag2O(s)+SO3(g),2SO3(g) 2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
2SO2(g)+O2(g)。10min后反应达到平衡,此时c(SO3)为0.4mol·L-1、c(SO2)为0.1mol·L-1,则下列叙述中不正确的是( )
A.SO3的分解率为20%
B.容器内气体的密度为40g/L
C.达到平衡时分解的Ag2SO4固体为0.5mol
D.10min内用O2表示的该反应的反应速率为0.005mol/(L·min)
参考答案:C
本题解析:c(SO2)为0.1mol·L-1,则消耗的三氧化硫是0.1mol·L-1,所以三氧化硫的起始浓度是0.1mol·L-1+0.4mol·L-1=0.5mol·L-1,因此分解率是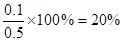 ,A正确。密度是气体的质量和容器容积的比值,所以密度是
,A正确。密度是气体的质量和容器容积的比值,所以密度是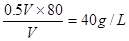 ,B正确。C不正确,因为容器的容积无法确定。平衡时氧气的浓度是0.05mol·L-1,所以用氧气表示的反应速率是
,B正确。C不正确,因为容器的容积无法确定。平衡时氧气的浓度是0.05mol·L-1,所以用氧气表示的反应速率是
 ,D正确,答案选C。
,D正确,答案选C。
本题难度:一般
3、计算题 在体积固定的密闭容器中N2与H2发生反应:N2(g)+3 H2 2 NH3
2 NH3
达到平衡时c (N2)=3.5 mol·L-1,c (H2)=1 mol·L-1,c (NH3)=5 mol·L-1,求:
(1)N2和H2的起始浓度(4分)
(2)N2的转化率(2分)(要求有解题过程)
参考答案:(1)6mol·L-1,8.5mol·L-1?(2)41.67%
本题解析:
试题解析:(1)根据物质参加反应时各物质的物质的量之比等于化学方程式中化学计量数之比,因此由平衡时氨气的浓度可计算出反应过程中氮气、氢气消耗的浓度,加上平衡时的浓度可得初始浓度。
(2)转化率=消耗的浓度/初始浓度×100%,可求出氮气的转化率。解题步骤如下:
解:(1)N2和H2的起始浓度分别为6mol·L-1,8.5mol·L-1?(共4分)
(2)N2的转化率41.67%?(2分)
(1)设N2与H2发开始浓度分别为x、y,转化为n,则
N2(g)+3H2(g)?2NH3(g),
开始? x? y? 0
转化? n? 3n? 2n
平衡3.5? 1?5
2n=5,解得n=2.5,
所以x=3.5+2.5=6mol/L,
y=1+3×2.5=8.8mol/L,
答:N2和H2的起始浓度分别为6mol?L-1、8.5mol?L-1;
(2)N2的转化率为:2.5mol/L/6mol/L×100%=41.67%。
本题难度:一般
4、填空题 lmol MnO2粉末加入50mL过氧化氢的溶液里(ρ=1.1g·L-1),在标准状况下,放出气体的体积V和时间t的关系曲线如图所示
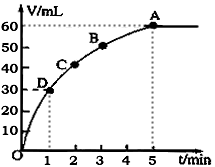
(1)实验时放出气体总体积是__________
(2)放出一半气体所需的时间约为__________
参考答案:(1)60ml
(2)1min
本题解析:
本题难度:一般
5、计算题 在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,发生反应:2SO2 + O2  2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)平衡常数K。
参考答案:(1)60%? (2)7.5L/mol
本题解析:10L密闭容器在10min内各物质浓度发生的变化如下:
2SO2?+? O2? ?2SO3
?2SO3
起始浓度(mol/L)0.50?0.45? 0
变化浓度(mol/L)0.30? 0.15? 0.30
平衡浓度(mol/L)0.20? 0.30? 0.30
则:(1)10min内SO2的转化率为:
(2)平衡常数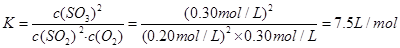
点评:对于化学平衡的相关计算,应利用“三段式法”,可以起到事半功倍的效果。另外应掌握化学平衡常数只与温度有关,温度不变,平衡常数的值不变。
本题难度:一般