微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 酸根离子RO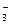 所含电子数比硝酸根离子NO
所含电子数比硝酸根离子NO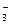 的电子数多10,则下列说法正确的是
的电子数多10,则下列说法正确的是
A.R和N为同周期元素
B.R和N是同主族元素
C.RO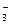 和NO
和NO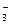 只可能被还原,不可能被氧化
只可能被还原,不可能被氧化
D.RO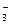 中R元素与NO
中R元素与NO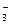 中N元素的化合价相同
中N元素的化合价相同
参考答案:D
本题解析:略
本题难度:一般
2、选择题&nbs p; 下列说法正确的是(?)
A.同周期主族元素的原子序数越大越易失电子
B.同周期主族元素的原子序数越大半径越大
C.同主族元素的原子序数越大非金属性越强
D.同主族元素的原子序数越大金属性越强
参考答案:D
本题解析:考查元素周期律的应用。同周期自左向右,原子序数逐渐增大,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下原子序数逐渐增大,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。所以答案是D。
本题难度:一般
3、选择题 短周期中有X、Y 、Z三种元素,Z可分别与X、Y组成化合物XZ2、ZY2,这三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可推知X、Y、Z依次为
A.Na、F、O? B.N、O、P? C.C、F、O? D.C、O、S
参考答案:D
本题解析:三种元素原子的核外电子数之和为30,每个XZ2分子的核外电子总数为38,由此可知,Z的原子序数和Y的原子序数之差是8,即二者是同主族元素,所以符合条件的只有选项D,答案选D。
点评:该题是中等难度的试题,试题设计新颖,灵活性强。在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
4、填空题 (9分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
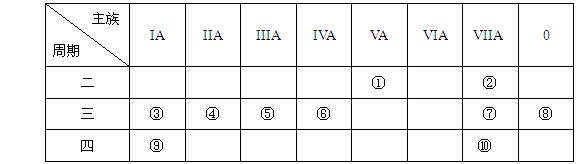
(1)在③~⑦元素中,原子半径最大的是?  ?,其离子的原子结构示意图为?
?,其离子的原子结构示意图为?
(2)元素的最高价氧化物对应的水化物中酸性最强的是?,?碱性最强的是 ?,呈两性的氢氧化物是?;
(3)按要求写出下列两种物质的电子式:①的氢化物?;?⑨的最高价氧化物的对应的水化物?;
(4)在⑦与⑩的单质中,化学性质较活泼的是?,可用什么化学反应说明该事实(写出反应的化学方程式):?。
参考答案:
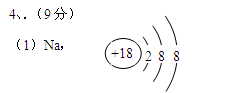
 (2)HClO4,KOH,Al(OH)3?(3)(略)
(2)HClO4,KOH,Al(OH)3?(3)(略)
(4)Cl2,2NaBr+Cl2=2NaCl+Br2
本题解析:略
本题难度:一般
5、选择题 4p轨道电子排布达到半充满的元素,其原子序数是
A.15
B.33
C.35
D.51
参考答案:B
本题解析:根据核外电子排布规律可知,15、33、35、51的核外电子排布分别是1s22s22p63s23p3、1s22s22p63s23p63d104s24p3、1s22s22p63s23p63d104s24p5、1s22s22p63s23p63d104s24p64d105s25p3,所以4p轨道电子排布达到半充满的元素是33号元素As元素,答案选B。
本题难度:一般