微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2一具有相同的电子层结构,离子半径:Z2->W一;Y的内层电子总数是最外层电子数的5倍。下列说法中不正确的是? (? )
A.W、M的某种单质可作为水处理中的消毒剂
B.电解YW2的熔融物可制得Y和W的单质
C.相同条件下,w的氢化物水溶液酸性比Z弱
D.X、M两种元素形成的一种化合物与水反应可生成M的某种单质
参考答案:C
本题解析:Y的内层电子数是外层电子数的5倍,可得Y的内层电子总数为10,最外层电子数为2,故为镁;X+与M2一具有相同的电子层结构,故为钠和氧,由Z、M同主族可得Z为硫,根据离子半径Z2->W一得W为氯;A、单质臭氧和氯气均能用于水的消毒剂,故A正确;B、电解熔融的氯化镁可制得镁和氯气单质,B正确;W的氢化物为HCl,Z的氢化物为H2S,酸性HCl>H2S,C错误;钠和氧构成的化合物过氧化钠和水反应生成氧气,D正确;故选C。
本题难度:一般
2、选择题 下列表达式错误的是( )
A.甲烷的电子式: 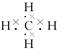
B.氮原子的L层电子排布图: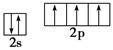
C.硫离子的核外电子排布式:1s22s22p63s23p4
D.碳12原子: 612C
参考答案:C
本题解析:硫离子的核外电子数是18个,其核外电子排布式为1s22s22p63s23 p6,选项C不正确,其余选项都是正确的,答案选C。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住。
本题难度:简单
3、简答题 (12分)(1)下列原子的外围电子排布式(或外围轨道表示式)中,那一种状态的能量较低?并指出处于能量较低状态时原子中的未成对电子数

(2)31号元素镓(Ga)是半导体材料之一。
①写出镓原子的电子排布式,指出镓元素在元素周期表中的位置。
②写出镓元素的最高价氧化物、氯化物的化学式。
参考答案:(1)①B? 3个? ②A? 1? ③A? 6个?(共6分)
(2)①1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1?(2分)
第四周期ⅢA族?(2分)
②Ga2O3? GaCl3?(2分)
本题解析:(1)①因为轨道中的电子处于全充满或半充满是稳定的,B稳定,其中未成对电子数3个,答案选B。
②3s的轨道的能量低于3p的,能量越低越稳定,A正确,其中未成对电子数是1个,答案选A。
③因为轨道中的电子处于全充满或半充满是稳定的,A正确,其中未成对电子数是6个,答案选A。
(2)①根据构造原理可知,镓原子的电子排布式为1S2 2S2 2P6 3S2 3P6 3d10 4S2 4P1,所以镓元素在元素周期表中的位置第四周期ⅢA族。
②第ⅢA元素的最高价是+3价,所以最高价氧化物、氯化物的化学式分别是Ga2O3、GaCl3。
本题难度:一般
4、填空题 X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
元素
| 相关信息
|
X
| 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2
|
Y
| 地壳中含量最高的元素
|
Z
| 存在质量数为23,中子数为11的核素
|
W
| 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质
|
R
| 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色
|
?
(1)W在元素周期表中的位置为?;X、Y、Z、W四种元素的原子半径从大到小的顺序是?(用元素符号表示)。
(2)X与氢两元素按原子数目比1∶3和2∶4构成分子A和B,A的结构式为?;B的电子式为?。化合物ZY中存在的化学键类型为?。
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为?,其最高价氧化物对应的水化物的化学式为?。该族二、三、四周期元素的气态氢化物的稳定性从大到小的顺序是?(用化学式表示)。
(4)用RCl3溶液腐蚀铜线路板的离子方程式为?。检验溶液中R3+常用的试剂是?,可以观察到的现象是?。
(5)Z W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2
W合金(Z17W12)是一种潜在的贮氢材料,由Z、W单质在一定条件下熔炼而成。该合金在一定条件下完全吸氢的反应方程式为:Z17W12+17H2 17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为?。
17ZH2+12W,得到的混合物Q(17ZH2+12W)在6.0 mol·L-1HCl溶液中能完全释放出H2。1 mol Z17W12完全吸氢后得到的混合物Q与上述盐酸完全反应,释放出H2的物质的量为?。
参考答案:(1)第三周期ⅢA族 ?Mg>Al>N>O
(2)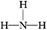 ? H∶
? H∶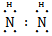 ∶H ?离子键
∶H ?离子键
(3)33 H3AsO4?NH3>PH3>AsH3
(4)2Fe3++Cu 2Fe2++Cu2+?KSCN溶液 溶液呈红色
2Fe2++Cu2+?KSCN溶液 溶液呈红色
(5)52 mol
本题解析:蛋白质主要含有C、H、O、N等元素,由化合价可知X为N;Y为O、Z为Mg、W为Al、R为Fe;(2)氮原子最外层有5个电子,每个氢原子形成3个共价键,所以N2H4的结构式为 ,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。
,然后依据结构式写出电子式;MgO属于离子化合物;(3)As位于第四周期,比上一周期同族元素的原子序数大18,由H3PO4可知As的最高价氧化物对应的水化物的化学式为H3AsO4;1 mol Mg17Al12完全吸氢后得到的混合物Q中含有17 mol MgH2、12 mol Al,与盐酸完全反应后分别生成34 mol H2、18 mol H2。
本题难度:一般
5、实验题 (13分) 现有短周期元素X形成的单质A与NaOH溶液反应,
有如下 转化关系:
转化关系: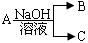 ,(若产物中有水生成则省略未表示出来)。
,(若产物中有水生成则省略未表示出来)。
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为?,实验室制备A的化学方程式为?;
(2)若常温常压下,A为非金属固态单质 ,且其在电子工业中有着重要的用途,则工业制取A化学方程式为?;
,且其在电子工业中有着重要的用途,则工业制取A化学方程式为?;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为?
?;其最高氧化物与NaOH溶液反应的离子方程式为?;
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途。一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下:
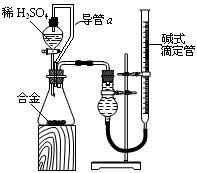
①装置中导管a的作用是? ?;
?;
②实验中准确测得4个数据:实验前该合金的质量m1 g,实验后残留固体的质量m2 g,实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL;则通常状况时气体摩尔体积Vm=____________L·moL-1。
参考答案:(13分) (1)Cl2+2OH-=Cl-+ClO-+H2 O MnO2+4HCl= MnCl2+ Cl2+2H2O
O MnO2+4HCl= MnCl2+ Cl2+2H2O
(2 )2C+SiO2="2CO+Si?" (3)2Al+2OH-+2H2O=2AlO2-+3H2
)2C+SiO2="2CO+Si?" (3)2Al+2OH-+2H2O=2AlO2-+3H2
Al2O3+2OH-=2AlO2-+H2O? (4)连通压强,便于液体流出。 18(V1-V2)10-3/(m1-m2)
本题解析:略
本题难度:简单