微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为? ?,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于? ?,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是? ?。
(2)当n=2时,B原子的结构示意图为? ?,B与C形成的晶体属于?晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为? ?,该晶体中最小的环共有? ?个微粒构成,微粒间的作用力是? ?。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是? ?,A、B、C、D四种元素的第一电离能由大到小的顺序是
? ?(用元素符号表示)。
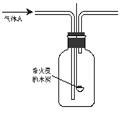
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
编号
| I
| II
| III
| IV
| V
|
V(O2)/mL
| 60
| 40
| 20
| 12
| 10
|
V(空气)/mL
| 40
| 60
| 80
| 88
| 90
|
?现象
| 木炭复燃
| 木炭复燃
| 木炭复燃
| 木炭有时燃烧,有时不燃烧
| 木炭
不复燃
|
?
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为? ?。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答:? ?(填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答:? ?(“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
编号
| 制取气体A(下列反应产生的混合气体)
| B中的现象
| 结论
|
a
| 在烧瓶中加热适量浓HNO3
4HNO3?△?4NO2↑+O2↑+2H2O↑
| 充满红棕色气体,木炭不复燃,火星熄灭
| NO2不支持燃烧
|
b
| 加热AgNO3固体
2AgNO3?△?2NO2↑+O2↑+2Ag
| 充满红棕色气体,木炭复燃
| NO2支持燃烧
|
c
| 加热Cu(NO3)2固体
2Cu(NO3)2?△?4NO2↑+O2↑+2CuO
| 充满红棕色气体,木炭复燃
| NO2支持燃烧
|
?
你认为a、b、c三个结论是否可靠?说出你的理由。
a.? ?,原因是? ?。
b.? ?,原因是? ?。
c.? ?,原因是? ?。
参考答案:A(1)1s22s22p4(1分) σ(1分)?分子间形成氢键(1分)
(2) +6? 2 4 (1分)?分子(1分)? sp3(1分)? 12(2分)?共价键或极性共价键(1分)
(3)第4周期IA族(1分)? N>O>Si>K(2分)
B B.(1)①29.6% (2分)?②否 (2分) ③能(2分)
(2)a.不可靠(1分)?反应产生的水蒸气及从溶液中蒸发出来的水蒸可使木炭火星熄灭(1分)? b.不可靠(1分)?反应产生的气体中O2的体积分数为1/3,高于29.6%,木炭复燃可能是由于O2浓度增大所致(1分)? c.可靠(1分)?反应产生的气体中O2的体积分数为1/4,低于29.6%,如果NO2不支持燃烧,木炭就不会复燃。(1分)
本题解析:A(1)C元素最外层电子数为3的整数倍且不超过8,故最外层电子数为3或6。一个电子层最外层不能有3个电子,故只能是两个电子层最外层有6个电子,C是O元素。
(2)本题考查了二氧化碳、二氧化硅的结构。C、Si同主族,但其氧化物的结构却不相似 ,二氧化碳是分子晶体,二氧化硅是原子晶体。
(3)该题最外层电子排布为4s1的元素最常见是K,但不是唯一答案,还可以是Cr、Cu。
B? (1) ①第4组情况下,木条有时复燃有时不复燃就是燃烧极限。0.88×0.2+0.12=0.296。
③只要氧气体积分数达到0.296,就可以燃烧。
(2)a 组、c组中产生的二氧化氮和氧气体积比都是4:1,但一组支持复燃,一组不支持复燃,说明一定有其他因素导致了差别,再联系特别注明水为气体,可推测a 组结论不可靠因为忽略了水蒸气的存在 。b组、c组都支持燃烧,但二氧化氮和氧气体积比不相同,再联系前面所计算的氧气的燃烧极限的问题可知b组结论不可靠 ,氧气超过燃烧极限了,二氧化氮不助燃也一样能燃烧。该题的思路就是控制单一变量。
本题难度:一般
2、填空题 H、D、T的中子数分别是_________,质量数分别是_____________,
同位素原子的?虽然不同,但______________基本上完全相同;
16O、17O、18O属____________,O2、O3、O4属________________,
某元素的同位素原子可以形成3种分子量不同的双原子分子,
则该元素有_________种同位素原子。
参考答案:0 1 2 、 1 2 3 、中子数、化学性质、 同位素、 同素异形、2
本题解析:考查原子的组成以及同位素的概念等。质子数和中子数之和是质量数,质子数相同质量数不同的核素互称为同位素。而同素异形体是指由同一种元素形成的不同单质,所以16O、17O、18O属于同位素,O2、O3、O4则属于同素异形体。根据排列组合可知,若某元素的同位素原子可以形成3种分子量不同的双原子分子,则其同位素一定是两种。
本题难度:一般
3、选择题 对于某些离子的检验及结论一定正确的是
A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42–
B.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32–
C.无色溶液焰色反应呈黄色,结论:试液是钠盐溶液
D.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
参考答案:D
本题解析:试题分析:A、加入氯化钡溶液产生的白色沉淀可能是AgCl,错误;B、加入稀盐酸产生无色气体可能是CO2或SO2,再说能与盐酸反应产生CO2气体的还可能是HCO3–,错误;C、无色溶液焰色反应呈黄色,只能说明该溶液中含有Na+,可能是钠盐溶液或氢氧化钠溶液。D、能使湿润红色石蕊试纸变蓝的气体只有NH3,能与强碱溶液反应产生NH3则说明溶液中含有NH4+,故D正确。
考点:考查常见离子的检验。
本题难度:一般
4、填空题 A、B、C、D、E五种短周期主族元素,原子序数依次增大。A原子的核外电子数等于最外层电子数;B原子的最外层电子数是次外层电子数的2倍;C原子的M层电子数与L层电子数相差7;D原子的最外层电子数是A、B、C三原子的最外层电子数之和。回答下列问题。
(1)元素B在周期表中的位置为第?周期?族;元素D简单离子的结构示意图为?。
(2)元素C、D简单离子的半径由大到小的顺序为(用离子符号表示)?。
(3)元素B可形成离子BH3-,下列与其具有相同电子数和质子数的微粒是?。
A.NH4+? B.OH-? C.F-? D.HS-
(4)元素A、C组成化合物甲CA,甲能与水反应产生一种强碱和一种气体,该反应的化学方程式为?。
(5)A元素有aA、a+1A、a+2A三种同位素,E元素有eE、e+2E两种同位素,二者所形成分子的相对分子质量有?种。
参考答案:(13分)
(1)二(1分);ⅣA(1分);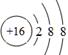 (2分)
(2分)
(2)S2- > Na+(2分)
(3)B C(2分)
(4)NaH + H2O =" NaOH" + H2↑(3分)
(5)5(2分)
本题解析:A原子的核外电子数等于最外层电子数,A为H元素;B原子的最外层电子数是次外层电子数的2倍,B为C元素;C原子的M层电子数与L层电子数相差7,C为Na元素;D原子的最外层电子数是A、B、C三原子的最外层电子数之和,D为S元素;E为Cl元素。
(1)B为C元素,在周期表中的位置为第二周期ⅣA族。D为S元素,原子序数是16,得到2个电子达到稳定结构,离子的结构示意图为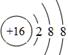 。
。
(2)C为Na元素,易失去一个电子达到稳定结构,电子层为2层,D为S元素,易得到2个电子达到稳定结构,电子层为3层,离子半径大小即S2- > Na+。
(3)注意离子电子数的计算,阴离子是得到电子而形成的,带负电荷,阳离子是原子失去电子而形成的,带正电荷。得失电子数等于其电荷数。
(4)A为H元素,C为Na元素,即CA为NaH,结合题中所给出的信息,方程式为NaH + H2O =" NaOH" + H2↑。
点评:以原子结构与位置关系为载体,考查化学用语、物质结构、半径比较等,难度中等,推断元素是解题关键,是对所学知识的综合运用,注意基础知识的理解掌握。
本题难度:一般
5、选择题 下列关于稀有气体的说法,不正确的是
A.原子的电子排布最外层不都是以p6结束
B.化学性质非常不活泼
C.原子半径比同周期ⅦA族元素原子的大
D.其原子与同周期ⅠA、ⅡA族阳离子具有相同电子排布式
参考答案:D
本题解析:A正确,例如He是1s2;稀有气体都满足稳定结构,化学性质稳定,B正确;C正确;D正确,其原子与下一周期ⅠA、ⅡA族阳离子具有相同电子排布式,答案选D。
点评:该题是基础性试题的考查,主要是考查学生对原子核外电子排布的熟悉了解程度,旨在培养学生的基础,提高学生的学习能力。
本题难度:简单