微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 砷为第4周期VA族元素,根据它在周期表中的位置推测,砷不可能具有的性质是( )
A.砷在通常状况下是固体
B.可以有-3、+3、+5等多种化合价
C.As2O5对应水化物酸性比H3PO4弱
D.砷的还原性比磷弱
参考答案:D
本题解析:略
本题难度:一般
2、选择题 X元素原子的L层比Y元素原子的L层少3个电子,X元素原子的核外电子总数比Y元素原子的核外电子总数少5个,则X、Y可形成的化合物是(?)
A.离子化合物Y(XO3)2
B.离子化合物Y2X3
C.共价化合物XY2
D.共价化合物Y3X2
参考答案:A
本题解析:L层最多只能容纳8个电子,X元素原子的L层比Y元素原子的L层少3个电子,而X元素原子的核外电子总比Y元素原子核外电子总数少5个,因此X元素原子核外比Y元素原子核外除少L层3个电子外,还少M层2个电子,所以X是N元素,Y是Mg元素,可形成离子化合物Mg(NO3)2和Mg3N2,因此只有A项正确。
本题难度:简单
3、简答题 已知X元素原子的K、L层的电子数之和比L、M层的电子数之和多1个电子。Y元素的原子最外层电子数比内层电子数少3个。Z元素核外有3个电子层,最外层有3个电子。W元素最高化合价是最低化合价绝对值的3倍,它在最高价氧化物中的质量分数为40%。
(1)Y和W的气态氢化物的稳定性为(用化学式表示)?>?。
(2)X单质在空气中加热生成的化合物是?化合物(填“离子”或“共价”)。
(3)X和Z的最高价氧化物对应水化物反应的离子方程式?。
(4)W的低价氧化物与Y单质的水溶液反应的化学方程式?。
(5)Y与Z形成化合物的化学式是?。实验测得当此化合物处于固态和液态时不导电,溶于水能导电。由此判断该化合物具有?键(填“离子”或“共价”)。
参考答案:(1)HCl? H2S?(2)离子
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)SO2+Cl2+2H2O=H2SO4+2HCl
(5)AlCl3?共价
本题解析:因为X元素的K、L层电子数之和比L、M层电子数之和大1,则X为Na;Y元素原子最外层电子数比内层电子数少3个,则Y为Cl;Z为Al;设W的最外层电子数为a,最低负价为a-8,根据a=3|a-8|可得a=6,W的最高价氧化物可表示为WO3,设W的相对原子质量为x,则W的百分含量为x/(x+48) ×100%=40%,可得x=32,所以W为S。
(1)Y的气态氢化物为HCl,W的气态氢化物为H2S,稳定性HCl>H2S。
(2)Na在空气中加热生成的是Na2O2,属离子化合物。
(3)X的最高价氧化物的水化物为NaOH,Z的最高价氧化物的水化物为Al(OH)3,两者反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O。
(4)S的低价氧化物为SO2,与Cl2反应的方程式为SO2+Cl2+2H2O=H2SO4+2HCl。
(5)Al与Cl形成的化合物为AlCl3,因为AlCl3在固态和液态不导电,在水溶液中导电,说明AlCl3中存在共价键。
本题难度:一般
4、选择题 下列叙述中正确的是(? )
A.在1s、2px、2py、2pz轨道中,具有球对称性的是1s轨道
B.4f、4s、3d原子轨道的能量关系是:E(4f)>E(4s)>E(3d)
C.磷原子的3个3p电子所在原子轨道的能量关系是:E(3px)<E(3py)<E(3pz)
D.CH2=CH2分子中,碳原子的2px轨道上的电子与氢原子的1s电子形成C—Hσ键
参考答案:A
本题解析:A项判断原子轨道的(电子云)形状,正确;B、C项判断能量顺序:E(4s)<E(3d)、E(3px)=E(3py)=E(3pz),错误;CH2=CH2分子中C—Hσ键是由C原子的sp2杂化轨道与H原子形成的。
本题难度:一般
5、填空题 (19分)已知A、B、C、D、E、F、C、H八种元素位于元素周期表前四个周期。A、B、C是三种非金属元素,A与B的原子的核外电子数之和与C原子的核外电子数相等且A、B、C能形成离子化合物。B与H位于同一主族,D的单质是中学化学常见的两性金属,E的单质是日常生活中用途最广泛的金属且其价电子数是G的两倍,F原子的最外电子层的p电子数是s电子数的两倍,D、H、F位于同一周期且原子序数依次增大,A、C、E、G、H的基态原子中未成对电子数均与其周期序数相同。请用化学用语回答以下问题:
(1)A、B、C形成的此化合物中存在的化学键的类型有?。E单质在常温下遇到A、B、C形成的另一化合物的浓溶液发生钝化现象,过量的E单质在此化合物的稀溶液中发生反应的离子方程式为?,E的基态电子排布式为?,来源:91考试网E3+与E2+的稳定性大小为?。
(2)B、C、D、H四种元素的第一电离能由大到小的顺序为?,电负性由小到大的顺序为?。
(3)A、C、G可形成一种相对分子质量为46的一元羧酸分子,其分子中存在的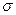 键和
键和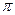 键的数目之比为?;F、G对应的氢化物中键能大小为F—H键?G—H键。
键的数目之比为?;F、G对应的氢化物中键能大小为F—H键?G—H键。
(4)等浓度、等体积的盐酸和氢氧化铀溶液分别与足量的D的单质反应放出的气体在常温常压下的体积比为?,将所得溶液混合刚含有D元素的两种物质间发生反应的离子方程式为?。
(5)由A、C、F可形成两种酸类化合物,用离了方程式说明它们的酸性强弱?。由A、C、F与钠四种元素按原子个数比为l:3:1:1组成一种化合物,其水溶液硅酸性,则该溶液中各种离子的浓度由大到小的顺序为?,向该溶液中滴入少量的氢氧化钡济液时发生反应的离子方程式为?。
参考答案:(19分)
(1)离子键、共价键(2分)
3Fe+8H++2NO-3=3Fe2-+2NO↑+4H2O?…………2分
1s22s22p63p63d44s2[Ar]3d54s2(1分)
Fe3+>Fe2-
(2)N>O>P>Al(1分);Al<P<N<O?…………1分
(3)4:1?…………1分
>?…………1分
(4)3:1(1分);
Al3-+3AlO-2+6H2O=4Al(OH)3↓?…………2分
(5)2H++SO2-3=SO2↑+H2O若H++HSO-4=SO2↑+H2O(合理即给分,2分);
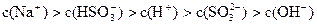
Ba2++2HSO-2=BaSO3↓+SO2-3+2H2O?…………2分
本题解析:略
本题难度:一般