微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知X+、Y2+、Z―、W2―四种离子均具有相同的电子层结构。下列关于X、Y、Z、W四种元素的描述,不正确的是
A.原子半径:X>Y>Z>W
B.原子序数:Y>X>Z>W
C.原子最外层电子数:Z>W>Y>X
D.还原性:X>Y,W2―>Z―
参考答案:A
本题解析:四元素在周期表中的位置关系如图所示:
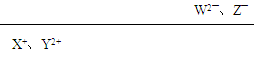
本题难度:一般
2、选择题 下列各组中互为同位素的是
A.O2和O3
B.H2和D2
C.CH4和C3H8
D. 2He和3He
参考答案:D
本题解析:
A、同素异形体;B、同属氢气;C、同系物;D、正确,具有相同质子数,不同中子数(或不同质量数)同一元素的不同核素互为同位素。2He和3He,中子数分别为0、1.
本题难度:简单
3、填空题
Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
⑴写出基态原子或离子的电子排布式:
①Fe3+_________________; ②Cr _______________; ③Cu _______________.
⑵比较 Fe2+与Fe3+的化学稳定性:Fe2+?Fe3+,半径大小:Fe2+?Fe3+
Ⅱ⑴在第三周期中,第一电离能最小的元素是________,电负性最大的元素是________(用元素符号表示)。
⑵第二、三、周期原子中p轨道半充满的元素是_______?(用元素符号表示)。
⑶第二周期原子中,未成对电子数等于周期系数的原子有?(用元素符号表示)
Ⅲ. (2010·滁州模拟)ClO、ClO、ClO中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构。
微粒
| ClO
| ClO
| ClO
|
立体结构
| ?
| ?
| ?
参考答案:(14分)Ⅰ. ⑴1s22s22p63s23p63d5、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
⑵Fe2+< Fe3+;Fe2+> Fe3+
Ⅱ①Na;Cl?②N;P?③C;O
Ⅲ.
微粒
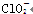
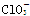
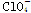
立体结构
V形
三角锥形
正四面体
本题解析:Ⅰ.(1)根据构造原理可知Fe3+、Cr、Cu的核外电子排布式分别是1s22s22p63s23p63d5、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
(2)由于铁离子中3d轨道电子处于半充满状态,稳定性强,所以稳定性是Fe2+< Fe3+;而微粒半径则是Fe2+> Fe3+。
Ⅱ⑴金属性越小第一电离能越小,非金属性越强,电负性越大。所以在第三周期中,第一电离能最小的元素是Na,电负性最大的元素是Cl。
⑵根据元素的核外电子排布式可知,第二、三、周期原子中p轨道半充满的元素是N和P。
⑶同样根据元素的核外电子排布式可知,第二周期原子中,未成对电子数等于周期系数的原子有C和O。
Ⅲ.根据价层电子对互斥理论可知,ClO、ClO、ClO中中心原子氯原子含有的孤对电子对数分别是(7+1-2×2)÷2=2、(7+1-3×2)÷2=1、(7-1-4×2)÷2=0,所以微粒的空间构型分别是V形、三角锥形和正四面体型。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是熟练记住构造原理以及价层电子对互斥理论,然后结合题意灵活运用即可,有利于培养学生的逻辑推理和抽象思维能力,提高学生的应试能力和学习效率。
本题难度:一般
4、选择题 下列顺序表述正确的是
A.酸性:H3PO4> HNO3> HClO4
B.稳定性:H2O > HF > H2S
C.原子半径:Na > Mg > O
D.还原性:F-> Cl-> S2-
参考答案:C
本题解析:A 错误,酸性:HClO4?> HNO3?> H3PO4?
B 错误,稳定性: HF > H2O > H2S?
C 正确。
D 错误,还原性: S2-?> Cl-> F-
本题难度:一般
5、选择题 下列说法正确的是
A.二氧化碳能与水反应生成相应的酸,二氧化硅也能与水反应生成相应的酸
B.D216O中,质量数之和是质子数之和的两倍
C.氯化氢的沸点比氟化氢的高
D.第ⅠA族的元素形成的氧化物均为碱性氧化物
参考答案:B
本题解析:略
本题难度:一般
|