微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:
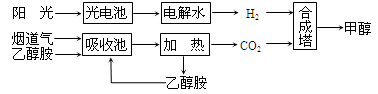
(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)]
| 500 K
| 600 K
| 700 K
| 800 K
|
1.5
| 45%
| 33%
| 20%
| 12%
|
2.0
| 60%
| 43%
| 28%
| 15%
|
3.0
| 83%
| 62%
| 37%
| 22%
|
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
参考答案:(1)有利于防止温室效应 (2分)
(2)HOCH2CH2NH2+H2O HOCH2CH2NH3++OH- (2分)
HOCH2CH2NH3++OH- (2分)
(3)CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol (3分)
(4)< (1分),< (1分)
(5) CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O (3分 )
(6)9.6(2分 )
本题解析:
(1)氢气与二氧化碳合成甲醇,减少了二氧化碳的排放,有利于防止温室效应
(2)HOCH2CH2NH2水解使溶液呈碱性,发生的离子方程式为HOCH2CH2NH2+H2O HOCH2CH2NH3++OH-
HOCH2CH2NH3++OH-
(3)根据盖斯定律,将甲醇与氢气的燃烧热化学方程式作相应调整,得△H=-285.8 kJ/mol×3-(-725.5 kJ/mol)=-131.9kJ/mol,所以合成甲醇的热化学方程式为CO2(g)+3 H2(g)= CH3 OH(l)+ H2O(l) △H=-131.9kJ/mol
(4)随温度升高,二氧化碳的转化率降低,说明升温平衡向逆向移动,正反应方向为放热反应,△H<0,反应物气体的总物质的量是8mol,生成物气体的总物质的量是4mol,所以△S<0;
(5)该电池负极是甲醚发生氧化反应,碱性介质中生成碳酸根离子,电极反应式为CH3 OCH3 -12e-+16 OH-=2CO32-+11 H2O
(6)0.5min甲醚的通入量是0.025mol,转移电子是0.3mol,根据得失电子守恒,Cu2++2e-=Cu,最终得0.15mol铜,其质量是9.6g。
本题难度:一般
2、简答题 原电池是化学对人类的一项重大贡献.
(1)某兴趣小组为研究原电池原理,设计如图装置.
①a和b不连接时,烧杯中发生反应的离子方程式是______.
②a和b用导线连接,Cu极为原电池______极(填“正”或“负”),电极反应式是______.Zn极发生______(填“氧化”或“还原”)反应.溶液中H+移向______(填“Cu”或“Zn”)极.
③无论a和b是否连接,Zn片均被腐蚀.若转移了0.2mol电子,则理论上Zn片质量减轻______g.
(2)有同学向把Ba(OH)2?8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行?______(填“是”或“否”),理由是______.

参考答案:(1)①a和b不连接时,该装置不构成原电池,锌和氢离子发生置换反应,离子反应方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑;
②a和b用导线连接,该装置构成原电池,铜作正极,正极上氢离子得电子发生还原反应,电极反应式为2H++2e-=H2↑;锌失电子发生氧化反应而作负极,放电时,电解质溶液中氢离子向正极铜电极移动,
故答案为:正;2H++2e-=H2↑;氧化;Cu;
③锌片减少的质量=0.2mol2×65g/mol=6.5g,故答案为:6.5;
(2)该反应不是氧化还原反应,且是吸热反应,所以不能设计成原电池,故答案为:否;此反应为非氧化还原反应,且反应吸热.
本题解析:
本题难度:一般
3、选择题 用锂制造的电池性能优越,如心脏起搏器中使用的新型Li-I2电池,其使用寿命已超过10年,Li-I2电池在使用时要不断地充电、放电,其中发生的某一化学反应可简化为:2Li+I2=2LiI,下列说法正确的是
[? ]
A.负极反应是2I--2e-=I2?
B.该电池以LiI水溶液为电解质溶液
C.以惰性非水有机溶剂为电解质?
D.这是电池放电的化学反应
参考答案:C
本题解析:
本题难度:一般
4、填空题 现有A、B、C、D四种金属片:①把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生;②把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应;③把A、C用导线连接后同时浸入稀H2SO4溶液中,电子流动方向为A→导线→C,根据上述情况,回答下列问题:
(1)在①中,金属片______发生氧化反应,金属片______?作正极;
(2)在②中,金属片______作负极;
(3)如果把B、D用导线连接后同时浸入稀H2SO4溶液,则金属片______上有气泡产生;
(4)上述四种金属的活动性由强到弱的顺序是______.
参考答案:(1)把A、B用导线连接后同时浸入稀硫酸溶液中,A上有气泡产生,所以A是正极,B是负极,该极上发生氧化反应,故答案为:B;A;
(2)把C、D用导线连接后同时浸入稀硫酸溶液中,D发生还原反应,所以D是正极,C是负极,故答案为:C;
(3)根据①可知金属活泼性顺序为B>A,根据②可知金属活泼性顺序为C>D,根据③可知金属活泼性顺序为A>C,所以金属活泼性顺序是在原电池中,B>A>C>D,如果把B、D用导线连接后同时浸入稀H2SO4溶液,则D为正极,该电极上有气泡产生,故答案为:D;
(4)根据①可知金属活泼性顺序为B>A,根据②可知金属活泼性顺序为C>D,根据③可知金属活泼性顺序为A>C,所以金属活泼性顺序是在原电池中,B>A>C>D,故答案为:B>A>C>D.
本题解析:
本题难度:一般
5、选择题 某原电池的总反应的离子方程式是:Zn+Cu2+=Zn2++Cu ,此反应原电池的正确组成是
[? ]
正极
负极
电解质溶液
A.
Cu
Zn
HCl
B.
Zn
Cu
CuS04
C.
Cu
Zn
CuS04
D.
Cu
Zn
ZnCl2
参考答案:C
本题解析:
本题难度:简单