微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (10分)(1)在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为____________?。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。)
(2)发射飞船时肼(N2H4)与NO2作推力能源,两者反应产生氮气和水蒸气。已知:
①N2(g)+2O2(g)=2NO2(g)?△H="+67.7" kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol
则肼与二氧化氮反应的热化学方程式为:?
(3)飞船使用的氢氧燃料电池具有高能、轻便和不污染环境等优点。氢氧燃料电池有酸式和碱式两种,其电池总反应均为:2H2+O2=2H2O。酸式氢氧燃料电池的电解质溶液是强酸溶液,其负极电极反应式可表示为:2H2-4e一=4H+,则其正极反应式为?;碱式氢氧燃料电池中的电解质溶液是强碱溶液,其正极电极反应式可表示为:O2+2H2O+4e一=4OH一,则其负极反应式为?
参考答案:(1)生成Cu(OH)2沉淀(填化学式),离子方程式为Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+。
(2)肼与二氧化氮反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g ) △H=-1135.7kJ/mol?
(3)正极反应式为O2+4e-+4H+=2H2O;负极反应式为H2-2e-+2OH-=2H2O
本题解析:(1)由两沉淀的Ksp可知,在c(Mg2+)与c(Cu 2+)相同的情况下, Cu(OH)2的离子积首先超过Ksp,先析出沉淀:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+
(2)肼与二氧化氮反应的化学方程式为:2N2H4+2NO2=3N2+4H2O,再根据盖斯定律2×②-①可知:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g ) △H=-1135.7kJ/mol
(3)酸式氢氧燃料电池:由总反应式减去负极反应式可得到正极反应式:O2+4e-+4H+=2H2O;
碱式氢氧燃料电池:由总反应式减去正极电极式可得负极反应式:H2-2e-+2OH-=2H2O
本题难度:一般
2、简答题 如图所示,组成的原电池:当电解质溶液为稀H2SO4时:Zn电极是______(填“正”或“负”)极,其电极反应为______,该反应是______(填“氧化”或“还原”,下同)反应;Cu电极是______极,其电极反应为______.

参考答案:该原电池中,锌易失电子作负极,电极反应式为:Zn-2e-═Zn2+,失电子的物质发生氧化反应,铜电极是正极,正极上氢离子得电子发生还原反应,电极反应式为:2H++2e-═H2↑,
故答案为:负,Zn-2e-═Zn2+,氧化,正,2H++2e-═H2↑.
本题解析:
本题难度:一般
3、选择题 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是
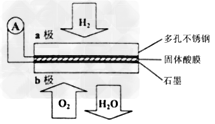
[? ]
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为:O2+2H2O+4e-=4OH-
C.每转移0.1mol电子,消耗1.12L的H2
D.H+由a极通过固体酸电解质传递到b极
参考答案:D
本题解析:
本题难度:一般
4、选择题 有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A→B;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2-+2e-→E,B-2e-→B2+则A、B、D、E金属性由强到弱的顺序为( )
A.A>B>E>D
B.A>B>D>E
C.D>E>A>B
D.D>A>B>E
参考答案:当A、B组成原电池时,电子流动方向A→B,则金属活泼性为A>B;
当A、D组成原电池时,A为正极,则金属活泼性为D>A;
B与E构成原电池时,电极反应式为:E2-+2e-→E,B-2e-→B2+,B失去电子,则金属活泼性为B>E,
综上所述,金属活泼性为D>A>B>E,
故选D.
本题解析:
本题难度:简单
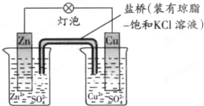
5、选择题 铜锌原电池(如图)工作时,下列叙述正确的是( )
A.正极反应为:Zn-2e-=Zn2+
B.盐桥中的K+移向ZnSO4溶液
C.电池反应为:Zn+Cu2+=Zn2++Cu
D.在外电路中,电子从负极流向正极;在电池内部,电子从正极流向负极